Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер
30 августа 2024
Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер
- 2526
- 0
- 1
Новостей в области разработки лекарств не становится меньше, и такое впечатление, что они всё интереснее. Наш обзор посвящен тем, которые приковали наибольшее внимание публики в прошедшем полугодии.
Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
2024 год перевалил за середину, но новостей за первую половину накопилось слишком много, чтобы оставлять всё на конец года. Сначала поговорим о самых заметных лекарствах, одобренных в первом полугодии: первое лекарство против стеатогепатита, первая клеточная терапия сóлидной опухоли, первый ингибитор теломеразы и другие.
Во второй части расскажем о клинических новостях, которые тоже радуют новизной и яркостью: первый успех в области боли за много лет, ноль случаев ВИЧ у принимавших профилактическое лекарство, ноль случаев рака шейки матки у привитых против ВПЧ.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Бывший неалкогольный стеатогепатит
Долгожданного одобрения добился препарат Resmetirom компании Madrigal для лечения стеатогепатита, связанного с метаболической дисфункцией (ССМД, или, как его называли раньше, неалкогольного стеатогепатита).
ССМД у большинства людей протекает незаметно, пока не переходит в тяжелые формы. Это поражение печени, при котором наблюдается стеатоз (накопление жировой ткани), воспаление и фиброз (замена функциональной ткани на соединительную) печени. Факторы ССМД — ожирение, диабет второго типа, инсулиновая резистентность, гиперлипидемия (повышенный уровень жиров в крови). При прогрессировании ССМД может перейти в цирроз печени, печеночную недостаточность, а в редких случаях — в рак печени (рис. 1).
Подозрение на ССМД появляется при повышении уровня печеночных ферментов аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), однако окончательный диагноз можно поставить только с помощью биопсии печени, на которой видна характерная картина жирового поражения, воспаления и фиброза.
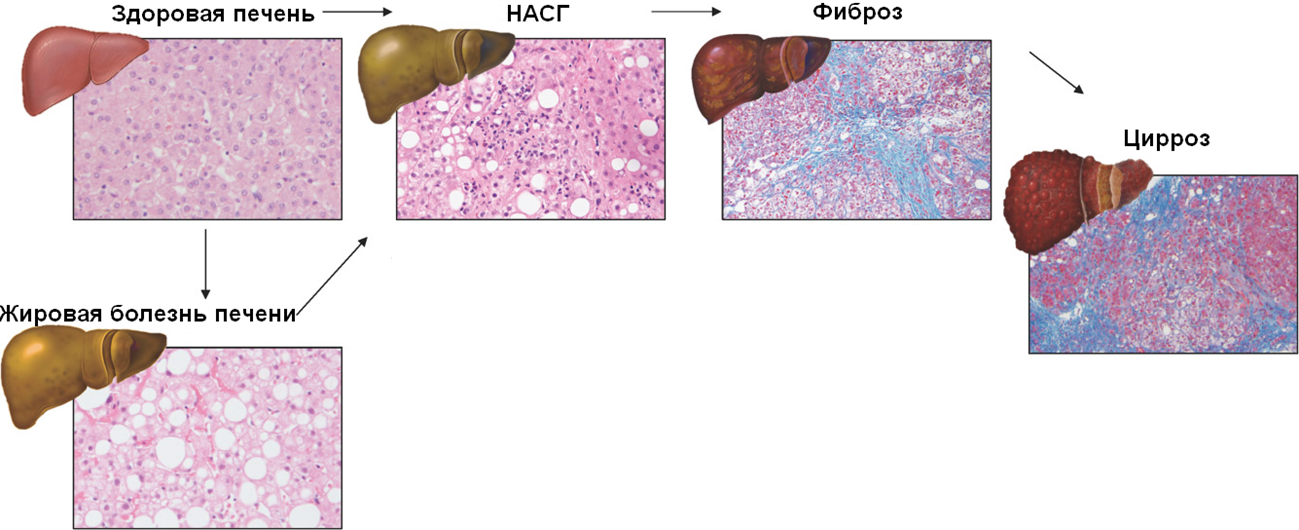
Рисунок 1. Прогрессия метаболического поражения печени. Жировая болезнь печени часто предшествует ССМД. Кстати, именно ею страдают гуси и утки, из печени которых делают паштет фуагра. Белые круги на биопсии жировой болезни и ССМД — это капли жира. Скопление фиолетовых точек на ССМД — признак воспаления. Синим цветом на биопсиях «Фиброз» и «Цирроз» окрашена фиброзированная ткань.
Вылечить ССМД невозможно, но лучший способ его профилактики и контроля — снижение веса. Однако также разрабатываются фармакологические подходы: это лакомый рынок для производителей лекарств, потому что ССМД распространяется всё шире, особенно в развитых странах, где он диагностируется у 3–12% населения. Вместе с тем, из-за недостаточного понимания патофизиологии ССМД до сих пор не было лекарств, которые бы эффективно воздействовали на его патогенез. Попытки исследовать такие препараты неизменно приводили к провалу.
Resmetirom стал первым одобренным препаратом по этому показанию, показав хорошие результаты в фазе 3 и по суммарной шкале (30% против 10% в плацебо), и по улучшению фиброза печени (26% против 14% в плацебо).
Resmetirom (рис. 2) — это низкомолекулярное соединение для перорального приема, селективный агонист рецептора тиреоидного гормона THR-β. Этот гормон выделяется щитовидной железой и регулирует процессы обмена жиров в печени. Он взаимодействует с двумя рецепторами в организме — THR-α и THR-β. THR-α в основном экспрессируется в сердце и костях, и воздействие на него приводит к токсичности. Поэтому важно было создать селективный препарат, который бы активировал только THR-β, но не THR-α. Сложность в том, что сайты связывания (место, куда прикрепляется молекула) у этих двух рецепторов отличаются всего одной аминокислотой. Однако медицинским химикам, как мы видим, успешно удалось решить эту задачу [2].
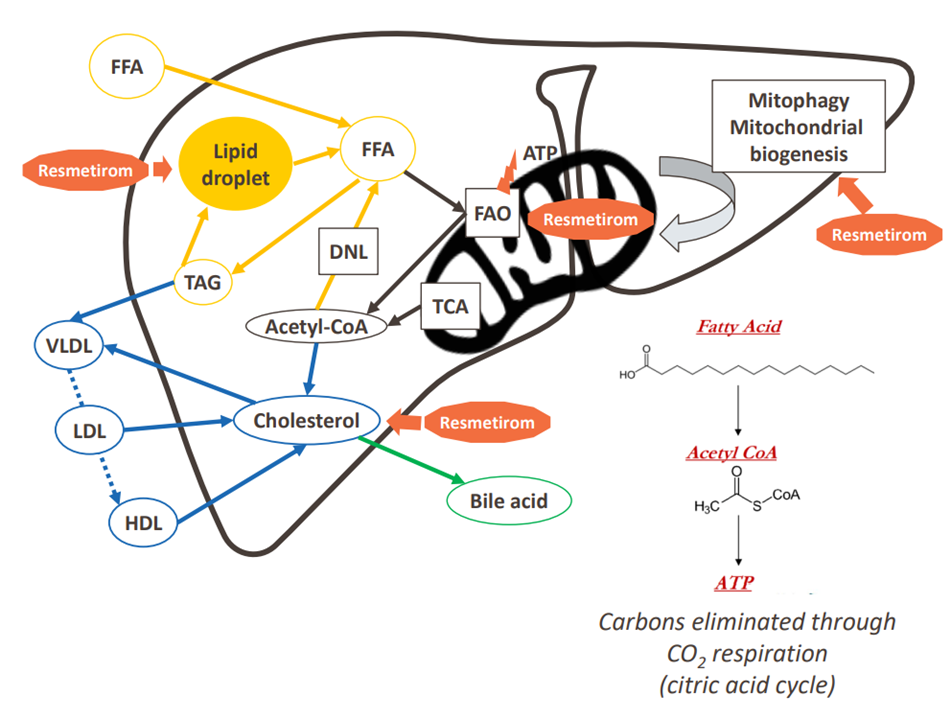
Рисунок 2. Как работает Resmetirom? Схематическое изображение печени, метаболизма жиров в ней и многогранного действия препарата.
презентация компании Madrigal
Важно, что Resmetirom одобрен без требования подтверждать диагноз с помощью биопсии, что намного облегчает его применение.
В разработке находится еще несколько перспективных молекул, которым теперь придется соревноваться с Resmetirom. Так, агонисты GLP-1 [3], которые произвели революцию в ожирении, теперь исследуются и по ССМД (для семаглутида уже есть положительные данные [4], пока, правда, из ретроспективного исследования).
Первая клеточная терапия сóлидной опухоли
В феврале 2024 года произошло историческое событие: FDA (Управление по пищевым продуктам и лекарствам США) впервые одобрило клеточную терапию сóлидных опухолей Lifileucel! Добилась этого компания Iovance со своими TILs (опухоль-инфильтрирующие лимфоциты) по показанию метастатическая меланома.
В мире одобрено уже шесть CAR-T, однако все они — для терапии «жидких» раков: лимфомы и множественной миеломы. Несмотря на многочисленные усилия, CAR-T против сóлидных («твердых») опухолей пока создать не удалось. О причинах этого мы писали в статье «Клетки, которые лечат людей» [5]. Но зато получилось создать и получить одобрение для TILs.
Как мы писали в статье «Генная терапия: познакомьтесь с лекарствами будущего» [6], такая терапия впервые была опробована на пациентах еще в 1988 году, но тогда это был несовершенный и штучный продукт, не готовый к коммерческому применению. Потребовалось 36 лет и усилия множества людей, чтобы добиться одобрения.
Путь Iovance к этому одобрению был непростым: компания готовилась к подаче досье в FDA еще в 2020 году. Однако возникли вопросы к аналитическим методам контроля вводимых клеток. На фоне смены менеджмента и пандемии их решение заняло слишком много времени, так что многие потеряли веру в ее успех.
Пока это всё еще несовершенный способ лечения, доступный только пациентам, которым не помогла стандартная терапия. Однако даже среди таких тяжелых пациентов на терапию ответила примерно треть, и почти половина из ответивших уже прожила более четырех лет.
В разработке и у Iovance, и у других компаний — улучшенные TILs и другие интересные клеточные продукты в том числе для сóлидных опухолей, так что одобрение lifileucel — только начало.
Генная терапия страшной болезни
FDA одобрило Lenmeldy компании Orchard Therapeutics (теперь часть японской компании Kyowa Hakko Kirin) для лечения метахроматической лейкодистрофии. Мы писали об этой болезни и об этом препарате раньше [7]. К моменту одобрения процедуру генной терапии прошло 37 детей, причем срок наблюдения уже достиг 14 лет. Все пролеченные дети живы, тогда как при естественном течении болезни к шести годам умирают 42% больных. К пяти годам 71% пролеченных смогли ходить без посторонней помощи, у 85% были нормальные тесты IQ и языковых способностей, чего без лечения вообще не бывает. Lenmeldy обновило рекорд стоимости лекарств — оно стоит $4,25 млн. (Кажется, следить за этим рекордом стало модно с золгенсмы [8].) Однако и популяция пациентов невелика — около 40 в год в США.
У многих людей есть сомнения, что стоит вообще тратить столько усилий на лекарства от ультраредких болезней. Однако помимо гуманизма и рыночного азарта, здесь есть и более практический смысл: так обкатываются технологии, которые в будущем, как мы все надеемся, позволят лечить и более распространенные заболевания.
Легочная гипертензия
FDA одобрило sotatercept компании Merck&Co, предназначенный для лечения легочной артериальной гипертензии.
Sotatercept представляет собой химерный белок, состоящий частично из антитела (Fc-домен, отвечающий за длительное нахождение в крови), а частично — из внеклеточного домена рецептора активина ActRIIA (нижняя панель рис. 3) [9]. Sotatercept показал превосходство над плацебо в плане физических способностей пациентов и ряда других критериев — в частности, он способен удлинить время до госпитализации или смерти. В отличие от других препаратов, которые только расширяют сосуды и не оказывают долговременного влияния на течения болезни, sotatercept воздействует на непосредственную причину болезни. Он «перехватывает» сигнальные белки, отвечающие за пропролиферативную активность и сдвигает баланс в сторону антипролиферативного действия.
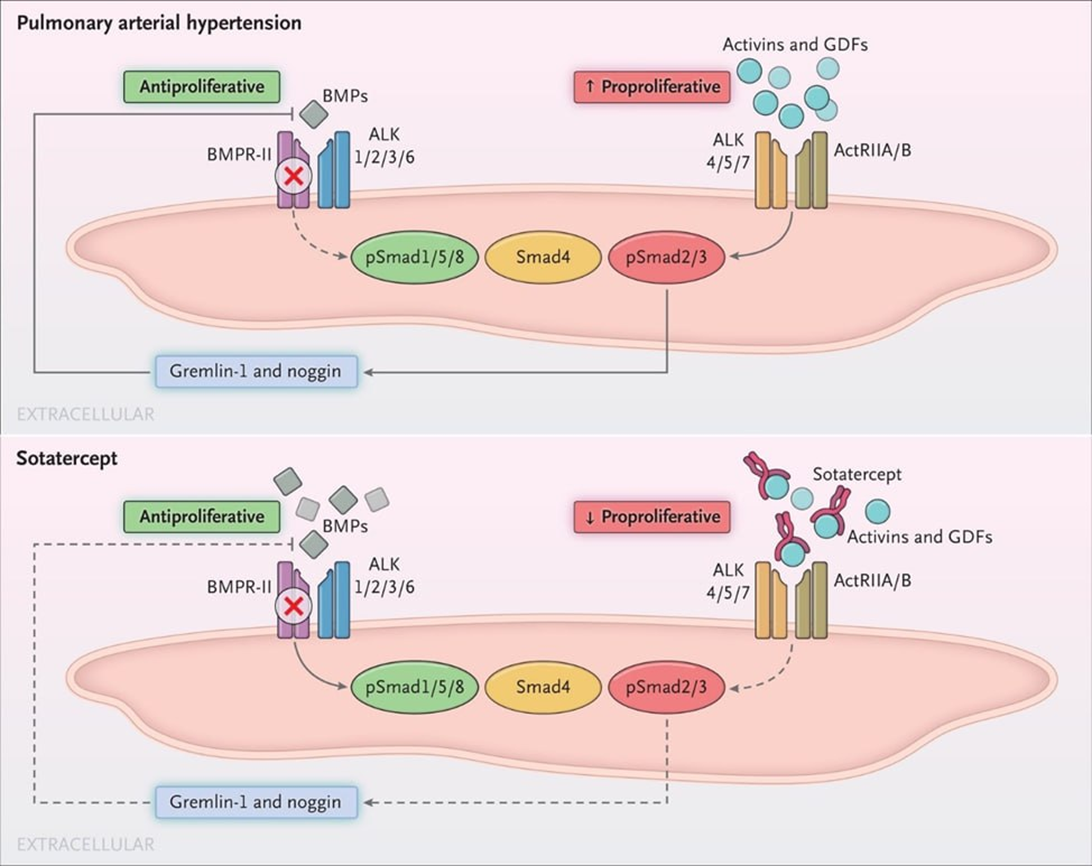
Рисунок 3. Механизм действия sotatercept. Схематическое изображение печени, метаболизма жиров в ней и многогранного действия препарата.
Интересно, что сначала препарат разрабатывался по совсем другим показаниям: остеопорозу, анемиям различного генеза, однако оказалось, что там эффективнее другой препарат, на основе рецептора активина ActRIIВ.
Sotatercept попал к Merck&Co в результате приобретения компании Acceleron за $11 млрд в 2021 году — хороший шаг, учитывая, что у препарата блокбастерное будущее, а Merck&Co нужно избавляться от зависимости от Китруды (это антитело против PD-1 — мегаблокбастер, который каждый год приносит компании более $20 млрд, но патент на который истекает уже в 2028 году).
Детские опухоли мозга
В области лечения опухолей мозга прогресс всё еще довольно медленный, поэтому любые новости привлекают внимание. Компания Day One получила одобрение для препарата tovorafenib по педиатрической глиоме низкой степени злокачественности — самой распространенной опухоли ЦНС у детей. Хотя эти опухоли растут медленно и обычно не метастазируют, 10-летняя выживаемость составляет 85%. Стандартным способом борьбы с глиомой является ее хирургическое удаление, однако не все опухоли удается вырезать, и часто происходят рецидивы.
Tovorafenib, пан-ингибитор Raf-киназ (рис. 4) — первый таргетный препарат, направленный на опухоли с любыми аберрациями в генах Raf, включая перестройки и слияния. До этого был одобрен препарат дабрафениб, активный только при наличии мутации BRAF V600E. Интересно, что ингибиторы Raf первого поколения усиливают рост опухоли, если она не несет мутацию V600E, видимо, за счет активации MAPK-пути (один из известных онкогенных сигнальных путей, отвечающих в том числе за рост педиатрических глиом).
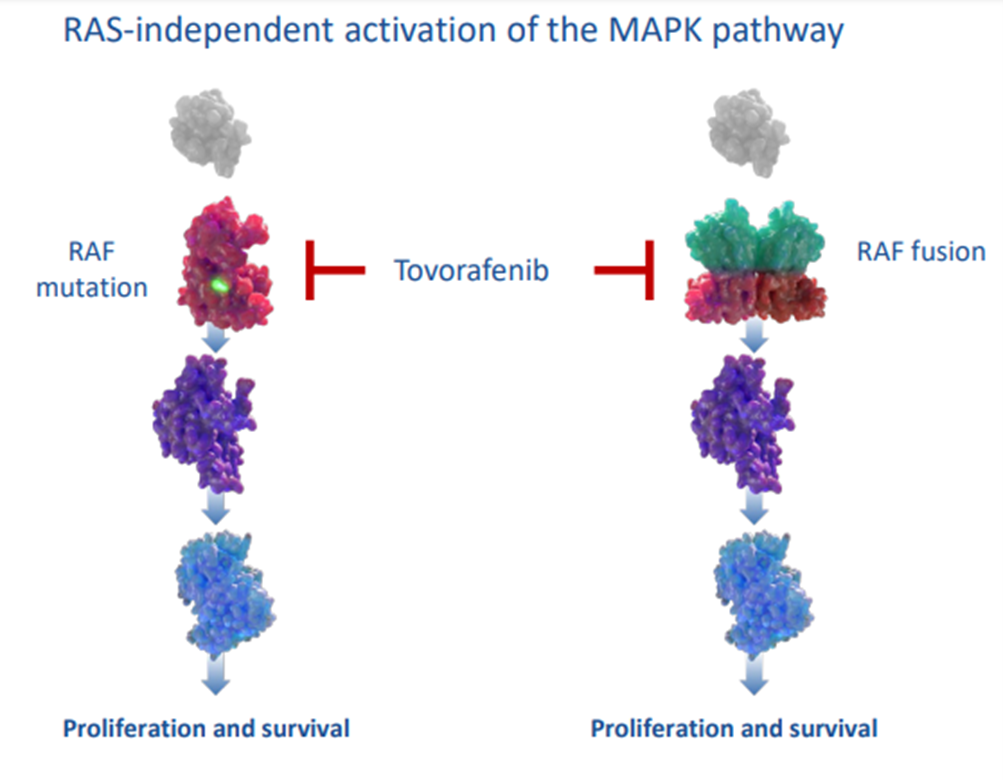
Рисунок 4. Tovorafenib способен ингибировать как мономерную форму Raf c мутацией, так и димерную.
Новый препарат в клиническом исследовании привел к снижению размера или исчезновению опухоли почти у 70% участников, при том что в исследовании участвовали те, кто перенес хирургию и химиотерапию. Теперь препарат исследуется на первой линии у пациентов с аберрантными генами Raf.
Еще одна хорошая новости в области глиом — одобрение препарата vorasidenib для взрослых, но оно произошло в августе, поэтому мы расскажем о нем в следующем выпуске.
Антитела против Альцгеймера
После единогласного решения FDA advisory committee о том, что антитело donanemab компании Eli Lilly против болезни Альцгеймера эффективно у пациентов с начальными симптомами, и что польза превышает риск, агентство одобрило препарат. Как и у всех остальных антител против амилоида-бета, у донанемаба есть риск мозговых осложнений (отеков мозга и кровотечений). Интересно, что Eli Lilly тестировала возможность отмены препарата после того, как ПЭТ показывал отсутствие бляшек через год.
Недавно вышла статья, посвященная как раз этой проблеме [10]. Напомню, в группе леканемаба через 18 месяцев пациенты ухудшались на 1,21 пункта по 18-балльной шкале и на 1,66 пунктов в группе плацебо. То есть абсолютная разница составила всего 0,45 баллов или 2,5%.
Однако во всех пресс-релизах и журналистских публикациях фигурирует величина 27%. Это относительная разница — 0,45, деленное на 1,66. Так тоже можно представлять результаты, но это не вся правда, и без абсолютной разницы — некоторое лукавство. Кроме того, 0,45 — это статистически значимый результат, но клинически он вряд ли значим: меньше того, что пациенты могут ощутить (по мнению авторов одного исследования, ощутима разница в 1 балл и более). В целом, все те же рассуждения справедливы и в отношении донанемаба.
Примечательно, что давно используемый в лечении болезни Альцгеймера донепезил (ингибитор ацетилхолинэстеразы) выглядит чуть ли не лучше леканемаба (рис. 5), хотя считается всего лишь симптоматическим и не слишком эффективным препаратом. Тут можно сказать — как можно сравнивать разные исследования! Но, как пишет известный медицинский химик и блогер Дерек Лоу (чей блог я всячески рекомендую), если разработчик леканемаба претендует на то, что это первый модифицирующий течение заболевания препарат, то разве не должна быть его эффективность видна невооруженным взглядом?!
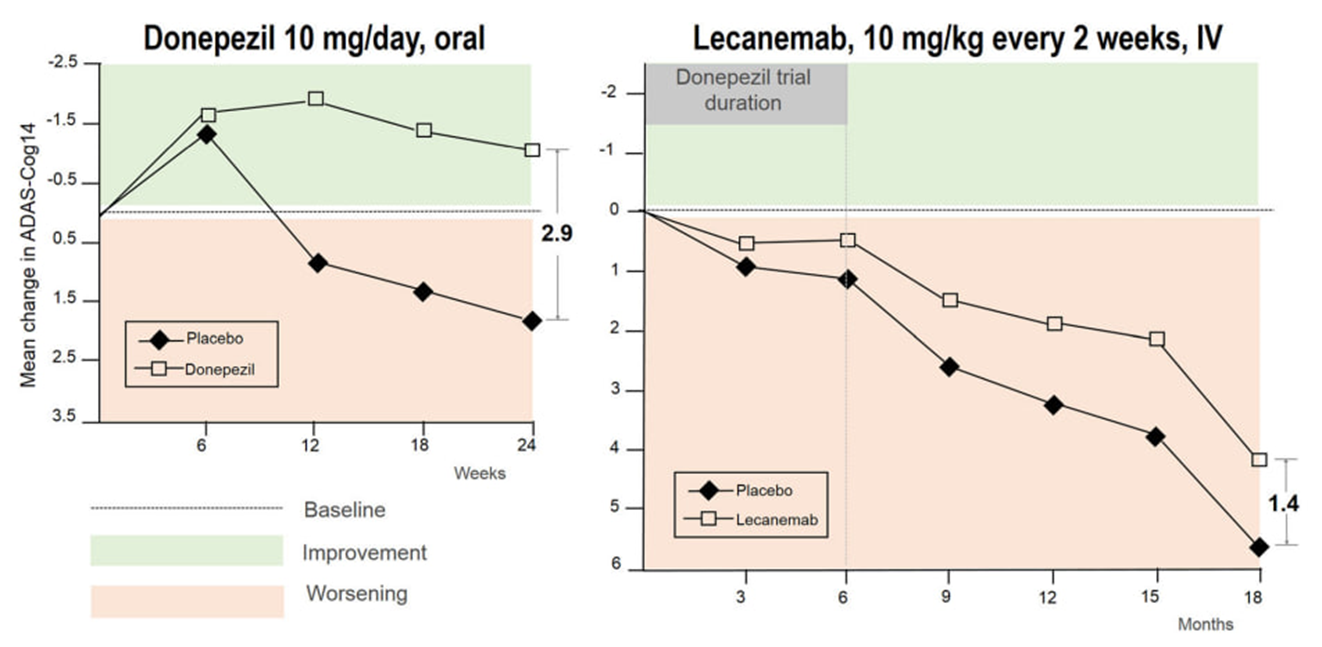
Рисунок 5. Сравнение эффективности донепезила и леканемаба на фоне плацебо. Примечательно, что только в группе донепезила наступило улучшение когнитивных функций, но не долговременное.
Теперь о безопасности. В исследовании леканемаба у 21% пациентов наблюдались отеки или кровотечения в мозгу, в исследовании донанемаба таких было 36%. В среднем у пациентов, принимавших эти препараты, наблюдалось уменьшение объема мозга по сравнению с плацебо на 26–33%. Так что и в США есть доктора, которые не будут рекомендовать эти препараты своим пациентам, несмотря на одобрение. Компании, регуляторы и общество продолжают следить за развитием ситуации, и только сбор данных позволит окончательно ответить на вопрос, оправданно ли применение этих препаратов в широкой популяции.
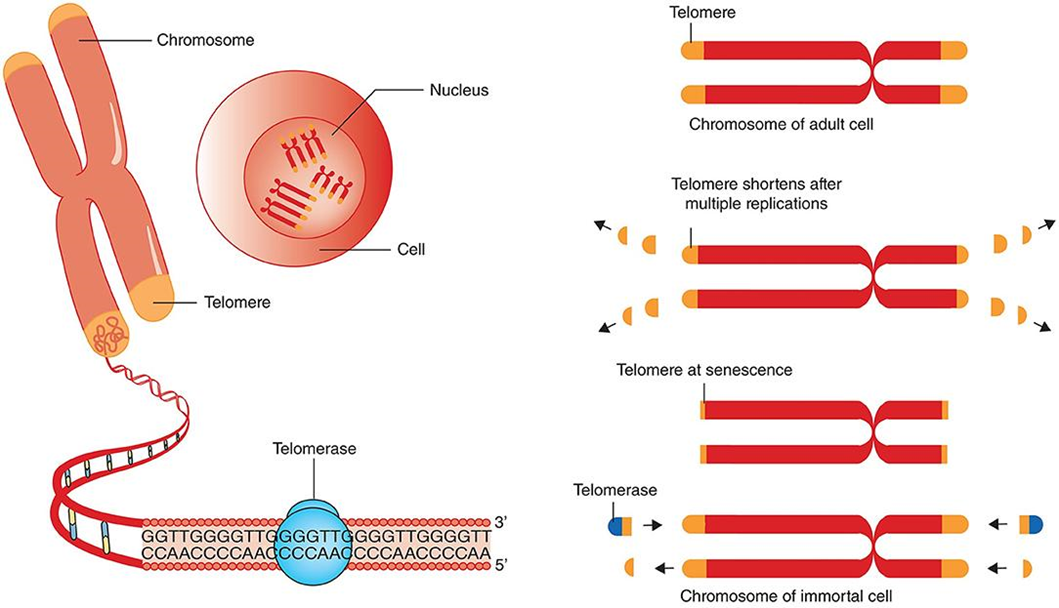
Первый теломеразный ингибитор
Теломеры открыли в 1930 году [11], и вот, не прошло и ста лет, как было одобрено первое лекарство, ингибирующее фермент теломеразу. Но обо всем по порядку.
На концах человеческих хромосом находятся нуклеотидные повторы — теломеры, которые при каждом удвоении ДНК перед делением клеток укорачиваются в связи с особенностью ферментов, отвечающих за репликацию ДНК [12]. Когда теломеры становятся слишком короткими, клетка впадает в сенесцентное («старческое») состояние, поэтому у обычных клеток число делений ограниченно. Однако есть специальный фермент теломераза, который удлиняет теломеры. В норме он активен в клетках зародышевой линии (предшественниках сперматозоидов), клетках эпидермиса, активированных лимфоцитах и в некоторых стволовых клетках — то есть там, где у клеток есть необходимость много делиться. Разумеется, теломераза активируется и во многих раковых клетках, что дает им возможность делиться неограниченно.
С момента открытия теломеразы в 1984 году не прекращаются попытки воздействовать на нее: активировать в обычных клетках, чтобы замедлить их старение, и ингибировать в раковых, чтобы они перестали делиться. Баланс здесь очень тонкий, и нарисованная выше картина очень упрощена: так, в клетках разных типов разное соотношение между длиной теломер и старением.
Впрочем, с раком всё вроде более понятно: теломераза активирована в 85–95% случаев рака, и, казалось бы, работающий ингибитор подобрать нетрудно, так? Нет. Как всегда, всё сложнее: теломераза работает не одна, а в составе комплекса белков, и пока удалось подобрать лишь один ингибитор с невысокой токсичностью — imetelstat. И даже его разработка была остановлена по ряду других показаний, и в итоге он одобрен пока только для лечения миелодиспластического синдрома с низким риском . Видимо, дело в том, что после ингибирования теломеразы должно пройти слишком много времени, пока раковые клетки «почувствуют» эффект препарата.
Редкого хронического онкологического заболевания костного мозга, которое в некоторых случаях превращается в острый миелоидный лейкоз.
Imetelstat представляет собой 13-членный олигонуклеотид, модифицированный остатком пальмитиновой кислоты, который облегчает его проникновение в клетки и за гематоэнцефалический барьер [14]. В клиническом исследовании он показал способность снижать потребность пациентов в переливаниях крови: 40% пациентов смогли обходиться без него 8 недель против 15% в плацебо группе. 28% смогли обходиться без переливания 24 недели, против 3,3% в группе плацебо. По словам докторов, это значимый результат, и, хотя большинство пациентов в конце концов прогрессирует, важно иметь больше лекарств, чтобы перебирать их в течение жизни.
Возможно, в будущем удастся создать какие-то более совершенные модуляторы теломеразы для лечения старения и рака, но пока что imetelstat — единственный выхлоп открытия, за которое в 2009 году была выдана Нобелевская премия [11].
Провал экстази
Заканчивая разговор об одобрениях лекарств, остановимся и на неуспешном случае.
Разработка различных психоделических и наркотических препаратов для лечения психических расстройств — популярное нынче дело [15–17]. Каннабис, ЛСД, экстази, их производные, различные экстракты грибов пытаются приспособить для лечения депрессий, стрессов, тревожности, паники и так далее. Пока, правда, не удается убедительно показать, что польза от таких вмешательств превышает риск, и отделить полезные эффекты от психозов, галлюцинаций, привыкания и других негативных черт, присущих этим препаратам.
Компания Lykos предоставила в FDA данные по терапии посттравматического стрессового расстройства (ПТСР) с помощью MDMA (экстази), и экспертная комиссия проголосовала против одобрения. Между тем, компания провела шесть фаз 2, две фазы 3, и все они были успешными! Несмотря на то, что новых лекарств против ПТСР FDA не одобряло 25 лет, члены комиссии решили, что вероятность разослепления в таких исследованиях слишком велика, а большинство участников исследования ранее принимали экстази, то есть симптомы им хорошо знакомы. Поэтому FDA в итоге потребовало от компании проведения еще одного исследования фазы 3. Компания не согласна и считает, что вероятность влияния разослепления на результаты мала, поэтому будет снова подавать досье в FDA в надежде на изменение позиции регулятора.
Теперь перейдем к заметным клиническим новостям.
Клеточная терапия рака печени
Выше мы упоминали о неудачах CAR-T в сóлидных опухолях, но, возможно, 2024 год переломит эту тенденцию? В этом году на ASCO (крупнейший онкологический конгресс в США в начале июня) клеточная терапия компании AstraZeneca совместно с китайской AbelZeta показала 50% ответов у больных с поздней стадией рака печени.
Неоперабельный рак печени очень плохо поддается лечению (5-летняя выживаемость около 2% [18]), и опубликованная активность CAR-T многообещающая, хотя пока на небольшом числе пациентов (N=22) и с коротким сроком наблюдения (медиана 5,8 мес.). Снижение размера опухоли произошло у 20 пациентов. Правда, смущает, что медианное время до прогрессирования (mPFS) оказалось всего 4,3 месяца, но нужно дождаться более зрелых данных, чтобы делать выводы об эффективности. Пациенты включались очень тяжелые, медианное количество предшествующих линий терапии 3,5. Наблюдаются некоторые признаки дозозависимости, что говорит в пользу терапии.
Клеточная терапия направлена на белок GPC3, который экспрессируется на поверхности клеток рака печени и против которого давно пытались создать терапию, в том числе, CAR-T. Но такой яркий успех пока только у AstraZeneca/AbelZeta. Например, Takeda прекратила разработку своего CAR-T, который не показал ответов у 11 пациентов. У AbelZeta клетки помимо химерного антигенного рецептора (CAR) экспрессируют рецептор TGFβRII, который обеспечивает защиту лимфоцита от иммуносупрессивного окружения опухоли.
Посмотрим, каковы будут результаты более длительного наблюдения. Если они будут подтверждаться, эта терапия станет настоящим прорывом — первым CAR-T, который сработает в сóлидных опухолях.
Лекарство против боли
Разработка лекарств против боли — очень большая проблема. Уже много десятилетий в этой области не появляется ничего нового в добавление к двум существующим группам — нестероидным противовоспалительным и опиатам. Обе группы страдают серьезными недостатками, особенно опиаты — но ничего сравнимого по эффективности пока не придумали. Впрочем, даже менее эффективный препарат, но не обладающий такими нежелательными эффектами, как опиаты, пользовался бы большим спросом.
Компания Vertex, знаменитый разработчик лекарств против муковисцидоза [19], сообщила об успехе двух клинических исследований фазы 3 своего анальгетика. Препарат исследовали у пациентов, перенесших операции по исправлению формы живота (абдоминопластику) или по удалению одной из плюсневых костей (бунионэктомию).
Лекарство сравнивали с плацебо и с Викодином (сочетание опиатного анальгетика гидрокодона и парацетамола). Препарат превзошел по эффективности плацебо, но не показал преимуществ перед Викодином. Впрочем, количество нежелательных явлений оказалось меньше, чем даже в плацебо группе, и компания подала досье на одобрение в FDA. Оно будет рассмотрено в приоритетном порядке: решение ожидается до января 2025 года.
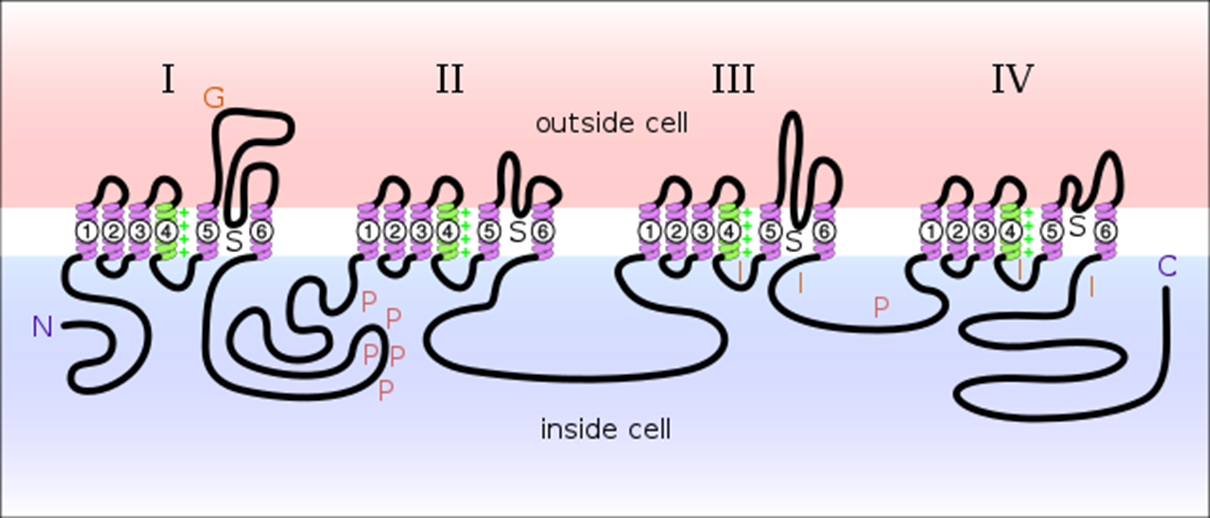
Мишень нового препарата — Nav1.8: это натриевый ионный канал на аксонах нервных клеток, участвующий в проведении нервного импульса (рис. 7). Это большой трансмембранный белок, который содержит пору для прохода ионов натрия снаружи клетки внутрь в ответ на изменение мембранного потенциала . В состоянии покоя потенциал на мембране аксона составляет −70 мВ [20]. В ответ на повышение потенциала до −55 мВ (потенциал действия) ионный канал открывается, и ионы Na+ поступают внутрь клетки, повышая потенциал до +30 мВ, что называется деполяризацией мембраны. Потом ионный канал закрывается и некоторое время находится в неактивном состоянии. Это обеспечивает распространение электрического импульса по аксону только в одном направлении. В проведении импульса участвуют и другие каналы — например, калиевые, которые пропускают K+ изнутри клетки наружу. После проведения импульса ионные насосы выкачивают ионы натрия из клетки и закачивают калий в клетку, чтобы восстановить потенциал покоя.
Ранее мы рассказывали о структуре более простого аналога эукариотического натриевого канала — аналогичного белка из бактерий: «О чем не знал Гальвани: пространственная структура натриевого канала» [21].
Оказалось, что именно селективное подавление Nav1.8 способно повлиять на возникновение нейропатической и воспалительной боли благодаря характеру экспрессии этого рецептора. Сложность в том, чтобы разработать достаточно специфичный ингибитор, который будет подавлять белок именно так, как нужно, и при этом не слишком повлияет на проведение нормальных нервных импульсов. Раньше такие попытки предпринимались, но все исследования были остановлены [22].
Препарат Vertex проходит исследование по диабетической нейропатии и другим показаниям, где остро ощущается потребность в новых анальгетиках.
Генная терапия слуха
Если против редких заболеваний глаз уже есть одобренная терапия (см. «Свет в конце туннеля: генная терапия болезней зрения» [23]), много разработок (и много провалов), то генная терапия слуха — это пока нечто неслыханное. Сразу две компании доложили о первых успешных результатах в этом году.
Подразделение Eli Lilly — компания Akouos — разрабатывает генную терапию отоферлина (OTOF). Это белок, отвечающий за везикулярный транспорт и экзоцитоз внутренних волосковых клеток (рис. 8). Дефекты кодирующего его гена приводят к постепенной потере слуха [24] — как правило, в детском возрасте. Akouos представила данные по первому пациенту возрастом 11 лет, страдающему глухотой с детства. Через 30 дней после введения в улитку уха векторов, несущих нормальный ген отоферлина (из-за ограничения на размер AAV-вектора [25] пришлось ген OTOF разделить на две части), слух мальчика стал восстанавливаться на всех частотах, а на некоторых достиг нормальных значений.
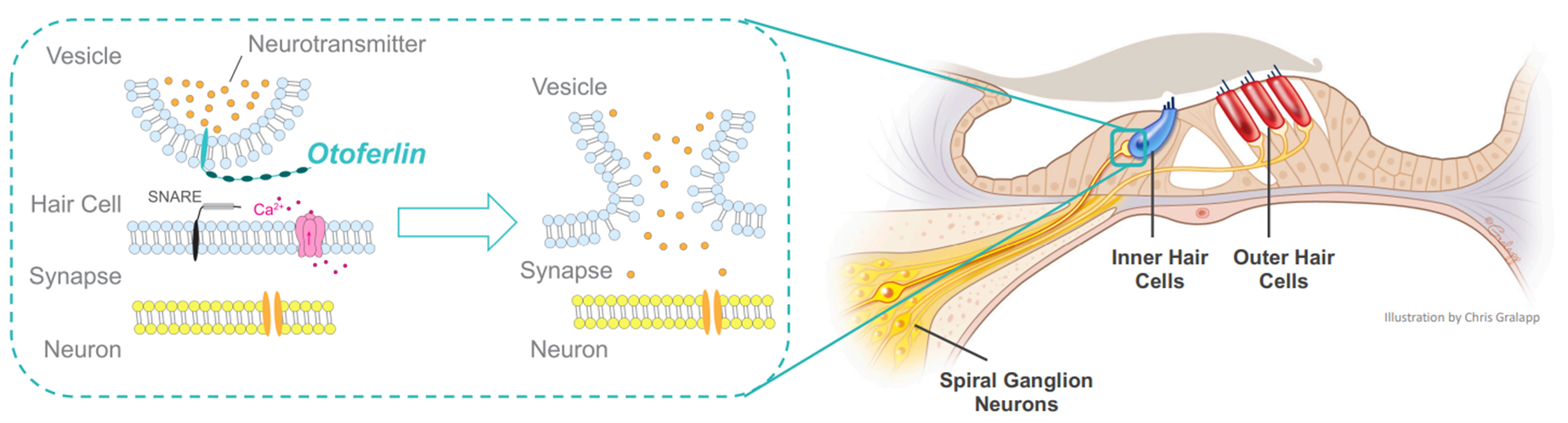
Рисунок 8. Схематичное изображение отоферлина и последствий его дисфункции. В отсутствие отоферлина нарушается синаптическая связь между внутренней волосковой клеткой и нейроном спирального ганглия, по которому сигнал поступает в мозг.
Несколькими месяцами позже компания Regeneron доложила похожие результаты у двух пациентов, также пролеченных двойным AAV-вектором [25] c геном OTOF. Одна пациентка, которую пролечили в возрасте 8 месяцев, через полгода начала слышать звуки без импланта, который у нее стоял во втором ухе. Второй пациент наблюдается пока только 6 недель, но у него тоже начались улучшения слуха.
Эти замечательные результаты дают надежду пациентам с мутацией OTOF, а в будущем открывают простор для лечения врожденной глухоты и с другими мутациями.
Тирзепатид и сонное апноэ
Невозможно обойти вниманием новости, связанные с агонистами глюкагоноподобного пептида GLP-1 . На сей раз препарат этой группы, тирзепатид (Eli Lilly), помог лечить апноэ сна. Это тяжелое осложнение ожирения, которое сопровождается храпом, нарушением сна и лежит в основе таких последствий, как артериальная гипертензия и рост сердечно-сосудистых рисков. Основной метод его лечения — CPAP (Continuous Positive Airway Pressure), то есть аппарат, который через маску нагнетает воздух в дыхательные пути под давлением и за счет этого устраняет апноэ. Как пишет сомнолог Александр Мельников, «метод очень эффективный, но не самый комфортный, связанный с определенными психологическими проблемами — и в результате с невысокой комплаентностью, то есть многие пациенты предпочитают храпеть, задыхаться, не высыпаться — но не привязывать себя к аппарату. Не самое дальновидное поведение, но, увы, широко распространенное».
Нашумевшее в прошлом году лекарство семаглутид мы отдельно отметили и в хит-параде бионовостей за 2023 год [26], и в обзоре новостей биофармы [28]. Почитайте об этом ярком препарате: «Оземпик: больше, чем средство для похудения» [3].
Тирзепатид на нынешний момент — самый эффективный препарат в плане снижения веса, потому что у него двойной механизм действия: семаглутид воздействует только на рецепторы GLP-1, а тирзепатид — на рецепторы и GLP-1, и GIP. В клиническом исследовании тирзепатида [28] в течение года на людях с ожирением почти у половины участников показатели дыхания во сне стали такими же, как у здоровых людей! Индекс апноэ-гипопноэ, характеризующий степень тяжести апноэ сна, снизился в среднем вдвое — и на фоне CPAP, и без (в контроле почти не изменился). Конечно, как и в других исследованиях, наблюдались нежелательные явления со стороны ЖКТ, и пока неизвестно соотношение пользы и риска при долговременном применении, а также насколько препарат сможет заменить CPAP, но это всё равно впечатляющие результаты — ни один лекарственный препарат раньше такого не добивался.
Генная терапия НАО
НАО расшифровывается как «наследственный ангионевротический отек». Это аналог отека Квинке, только имеющий генетическую природу. Пациенты с НАО испытывают регулярные болезненные приступы и могут внезапно умереть от отека, если он приведет к перекрытию дыхательных путей.
На рынке есть несколько препаратов для снижения частоты приступов, в первую очередь — ферментный препарат C1-ингибитора (поломка в гене которого и вызывает НАО). Однако, как и в случае других наследственных заболеваний, соблазнительно было бы создать терапию, которая бы вылечила пациентов раз и навсегда.
Один из лидеров генного редактирования, компания Intellia Therapeutics (основана Нобелевским лауреатом в области CRISPR Дженнифер Даудной), представила очень хорошие данные исследования первой фазы (рис. 9).
Продукт Intellia представляет собой липидные наночастицы с нуклеазой Cas9, которая разрезает ДНК, и направляющей РНК, которая указывает Cas9, что инактивировать нужно ген калликреина. Калликреин отвечает за проницаемость сосудов, и его инактивация должна приводить к снижению частоты приступов.
Так и получилось: у 8 пациентов из 10 приступы снизились до нуля, а у двух оставшихся было по одному приступу за период наблюдения. Это первые такие впечатляющие данные по генному редактированию in vivo! Предыдущие клинические данные относились к ex vivo редактированию [29], когда у пациентов выделяют клетки, редактируют в пробирке и вводят обратно.
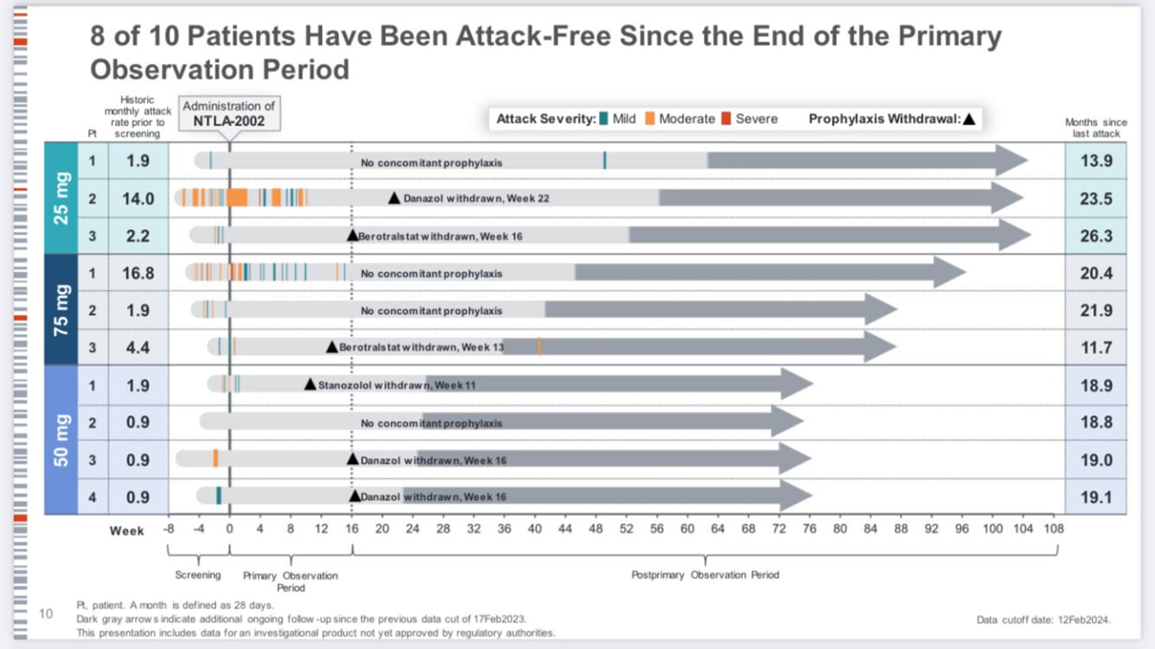
Рисунок 9. Данные исследования компании Intellia по наследственному ангионевротическому отеку. Видно, как у всех пациентов практически прекратились приступы после введения лекарств.
В 2025 году Intellia приступит к регистрационному исследованию.
РНК против транстиретинового амилоидоза
Компания Alnylam, лидер в разработке РНК-терапий, опубликовала одну из самых долгожданных новостей этого года. И она оказалась положительной! Речь идет о лекарстве вутрисиран против редкой болезни — транстиретинового амилоидоза (см. «Руку, ногу и сердце: редкий АТТR-амилоидоз» [30]). Препарат действует по механизму РНК-интерференции [31] и уже был одобрен в 2022 [32] для другой формы ATTR — c полинейропатией. А недавно были опубликованы данные исследования HELIOS-B у пациентов с кардиомиопатией при ATTR. Препарат снизил смертность через 42 месяца на 36% по сравнению с контрольной группой, которая включала и тех, кто получал препарат-конкурент tafamidis (Pfizer). Акции еще одного конкурента — BridgeBio — упали на 18% на объявлении результатов. Окончательные результаты исследования HELIOS-B будут опубликованы в августе. Интересно, сколько будет стоить препарат в случае одобрения. По ATTR-полинейропатии компания продает его за $460 000 в год, а tafamidis стоит $225 000 (что делает его самим дорогим препаратом для лечения сердечно-сосудистых заболеваний). Пациентов с кардиомиопатией на порядок больше, поэтому за рынок идет такая борьба. В разработке также находятся антисмысловой олигонуклеотид Ionis/AstraZeneca и генное редактирование Intellia.
Новости доконтактной профилактики ВИЧ
Компания Gilead опубликовала результаты исследования по профилактике ВИЧ, проведенного на 5338 африканских женщинах. Препарат ленакапавир, вводимый подкожно раз в полгода, полностью защитил участниц исследования от ВИЧ-инфекции, в то время как в двух контрольных группах заболели 1,4% и 1,8% участниц. Исследование было остановлено досрочно после того, как преимущество новой схемы профилактики стало очевидным.
Это еще одно достижение в ряду препаратов для так называемой доконтактной профилактики (ДКП или PrEP, от англ. pre-exposure prophylaxis), то есть их рекомендуется принимать незараженным людям с высоким риском заражения ВИЧ (группы населения с 3 и более случаев в год на 100 человек) для предотвращения заболевания. Первые препараты такого рода были одобрены в 2012 году и представляют собой таблетки для ежедневного приема. В 2021 году на рынок вышел каботегравир — внутримышечные инъекции раз в два месяца, которые превзошли таблетки по эффективности профилактики ВИЧ на 68–89%. ВОЗ также рекомендует женщинам использовать вагинальное кольцо с дапивирином, которое снижает вероятность заразиться на 27–35% и должно заменяться каждый месяц.
Исследование ленакапавира — первое, где не отмечено ни одного случая заражения. Gilead проводит второе исследование в других группах риска (гомосексуальные мужчины, трансгендеры, небинарные персоны). Его результаты ожидаются в следующем году, после чего компания подаст документы на регистрацию.
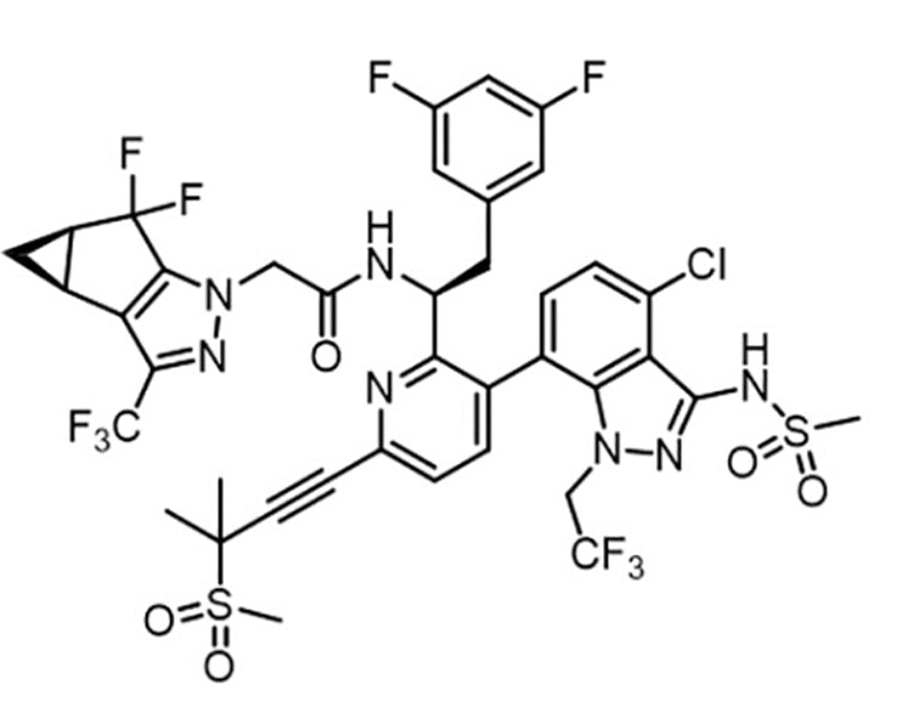
Рисунок 10. Структурная формула ленакапавира.
Ранее ленакапавир в виде таблеток и уколов уже был одобрен для лечения ВИЧ в составе комбинированной терапии у пациентов, не ответивших на первую линию терапии.
Прямых сравнительных исследований ленакапавира с каботегравиром не проводилось, в контрольных группах применялись пероральные препараты для PrEP.
Интересно, как вообще удалось создать малую молекулу, которую достаточно вводить раз в полгода — это очень необычно, потому что чаще всего они выводятся за несколько дней. Оказалось, что помимо очень высокого сродства к белкам капсида вируса и очень неэффективного удаления печенью и почками, при подкожном введении ленакапавир накапливается в так называемом депо. Грубо говоря, он выпадает в осадок из-за своей низкой растворимости в воде, и этот осадок в течение месяцев постепенно растворяется, образуя нужную концентрацию в крови. Ученым из Gilead повезло: они рассчитывали на ежемесячное введение по данным на животных, но у человека получилось еще реже [33]. Посмотрите на это чудо фармакологии (рис. 10): медицинские химики сказали бы, что на лекарство такая молекула не очень похожа, однако это оно и есть.
Особенностью доконтактной профилактики является то, что ее можно проводить только у незараженных, поэтому необходимо постоянно проверять статус ВИЧ. Если человек заразится ВИЧ, к препаратам для доконтактной профилактики может развиться резистентность, потому что их одних недостаточно для подавления развившейся инфекции, необходимо комбинировать их с другими. Кроме того, ВОЗ рекомендует использование PrEP в комбинации с презервативами.
Идеальным решением проблемы ВИЧ стало бы создание профилактических вакцин. Работа над ними ведется многие годы, но пока безуспешно — вирус слишком хорошо умеет «уходить» от иммунной системы. Не удалось пока создать и таблетку, которая бы позволила вылечить больного после заражения, как это удалось сделать тому же Gilead для гепатита С [34]. Однако успехи медицинской химии и вирусологии позволили создать эффективные средства лечения ВИЧ (тоже, впрочем, несовершенные с точки зрения нежелательных эффектов и переносимости), которые при хроническом применении позволяют людям с ВИЧ жить практически нормальной жизнью.
Доконтактная профилактика — важный способ борьбы с распространением ВИЧ и потенциальный путь к искоренению эпидемии. Показана корреляция между уровнем использования PrEP и числом новых случаев заболевания ВИЧ.
И здесь важны не столько новые препараты, сколько их стоимость и доступ к ним людей в группах риска, большинство из которых живут в странах с низкими доходами. К сожалению, охваченность PrEP пока далеко не полная — она одобрена только в 72 странах (рис. 11), и доступ людей в группе риска к ней не всеобщий, несмотря на усилия, предпринимаемые государственными и надгосударственными организациями, фармкомпаниями и благотворительными фондами.
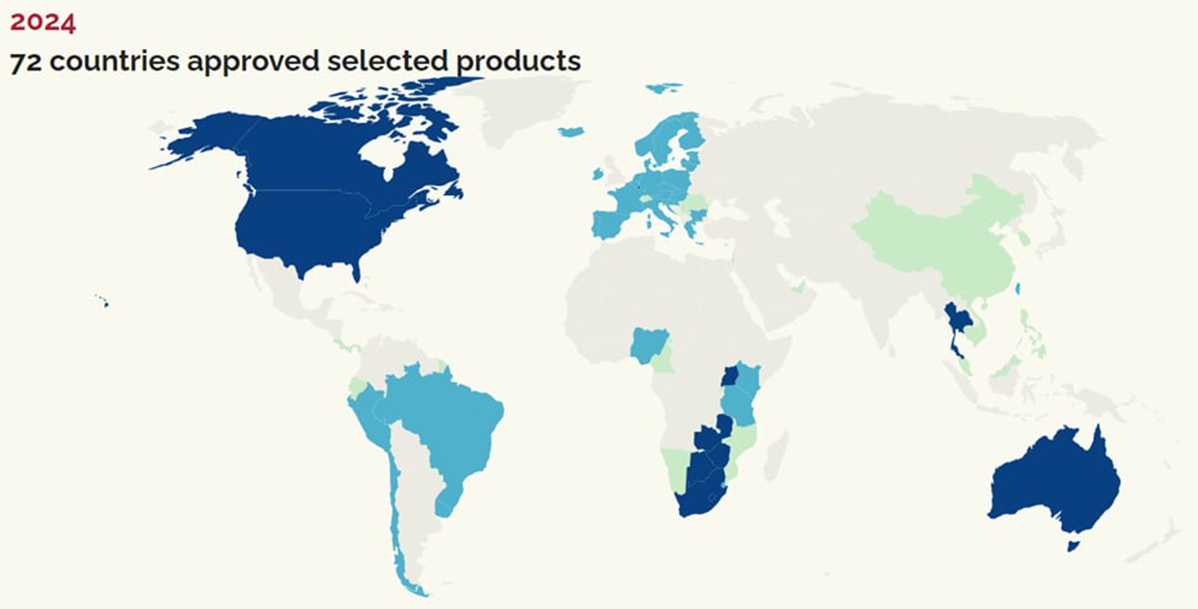
Рисунок 11. Страны, в которых одобрена PreP. Зеленый цвет — один продукт, голубой — два, синий — три.
Ноль случаев рака шейки матки после вакцинации
Завершим обзор хорошей новостью из области вакцинации: в Шотландии проанализировали данные по случаям рака шейки матки среди вакцинированных и невакцинированных вакциной от вируса папилломы человека (ВПЧ) [35]. Выяснилось, что хотя для вакцинации до 2012 применяли бивалентную вакцину Cervarix, которая защищает всего лишь от двух штаммов ВПЧ (HPV16 и HPV18), и не все получили полную вакцинацию в виде трех прививок, среди привитых в возрасте 12–13 лет наблюдалось 0 (прописью: ноль) случаев рака шейки матки! При этом период наблюдения составил 11 лет, а общее число проанализированных медицинских записей — почти полмиллиона: это пока самое обширное исследования связи вакцинации от ВПЧ и рака шейки матки. Данные по когорте вакцинированных в 14 лет и старше говорят о том, что полная вакцинация обеспечивает защиту от рака шейки матки на 73,8%.
Предыдущее большое исследование на тему вакцинации от ВПЧ из Финляндии показало, что наилучшие результаты по защите от вируса получаются, если вакцинировать не только девочек, но и мальчиков, и если покрытие вакциной составляет более 50%.
Литература
- Erin Cleveland, Andrew Bandy, Lisa B. VanWagner. (2018). Diagnostic challenges of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. Clinical Liver Disease. 11, 98-104;
- Martha J. Kelly, Sherrie Pietranico-Cole, J. Douglas Larigan, Nancy-Ellen Haynes, Charles H. Reynolds, et. al.. (2014). Discovery of 2-[3,5-Dichloro-4-(5-isopropyl-6-oxo-1,6-dihydropyridazin-3-yloxy)phenyl]-3,5-dioxo-2,3,4,5-tetrahydro[1,2,4]triazine-6-carbonitrile (MGL-3196), a Highly Selective Thyroid Hormone Receptor β Agonist in Clinical Trials for the Treatment of Dyslipidemia. J. Med. Chem.. 57, 3912-3923;
- Оземпик: больше, чем средство для похудения;
- Parth Shah, Megan White, Alex Sievert, Alexander Conway, Adam Kneepkens, et. al.. (2024). Semaglutide improves metabolic dysfunction‐associated steatohepatitis: A 10‐year retrospective study. JGH Open. 8;
- Клетки, которые лечат людей;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Генномодифицированные клетки борются со страшной болезнью;
- Самое дорогостоящее лекарство в мире;
- Marc Humbert, Vallerie McLaughlin, J. Simon R. Gibbs, Mardi Gomberg-Maitland, Marius M. Hoeper, et. al.. (2021). Sotatercept for the Treatment of Pulmonary Arterial Hypertension. N Engl J Med. 384, 1204-1215;
- Alberto J. Espay, Kasper P. Kepp, Karl Herrup. (2024). Lecanemab and Donanemab as Therapies for Alzheimer's Disease: An Illustrated Perspective on the Data. eNeuro. 11, ENEURO.0319-23.2024;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Теломеры и новые мишени протоонкогенной терапии;
- C.M. Buseman, W.E. Wright, J.W. Shay. (2012). Is telomerase a viable target in cancer?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 730, 90-97;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Дивный новый мир психоделической терапии;
- Новая жизнь психоделиков;
- Фармакофоры нейропластичности;
- Wattana Leowattana, Tawithep Leowattana, PathompThep Leowattana. (2023). Systemic treatment for unresectable hepatocellular carcinoma. World J Gastroenterol. 29, 1551-1568;
- Муковисцидоз — первые надежды;
- Формирование мембранного потенциала покоя;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Shaila Hameed. (2019). Nav1.7 and Nav1.8: Role in the pathophysiology of pain. Mol Pain. 15, 174480691985880;
- Свет в конце туннеля: генная терапия болезней зрения;
- Charles L. Ford, William J. Riggs, Tera Quigley, Orion P. Keifer, Jonathon P. Whitton, Vassili Valayannopoulos. (2023). The natural history, clinical outcomes, and genotype–phenotype relationship of otoferlin-related hearing loss: a systematic, quantitative literature review. Hum. Genet.. 142, 1429-1449;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- SciNat за декабрь 2023 #4: подводим итоги года — самые удивительные открытия и талантливые ученые;
- Обзор новостей биофармы за 2023 год;
- Atul Malhotra, Ronald R. Grunstein, Ingo Fietze, Terri E. Weaver, Susan Redline, et. al.. (2024). Tirzepatide for the Treatment of Obstructive Sleep Apnea and Obesity. N Engl J Med;
- Как болезни крови генной терапией лечили;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- РНК-интерференция: повторный успех;
- Susan J. Keam. (2022). Vutrisiran: First Approval. Drugs. 82, 1419-1425;
- Raju Subramanian, Jennifer Tang, Jim Zheng, Bing Lu, Kelly Wang, et. al.. (2023). Lenacapavir: A Novel, Potent, and Selective First-in-Class Inhibitor of HIV-1 Capsid Function Exhibits Optimal Pharmacokinetic Properties for a Long-Acting Injectable Antiretroviral Agent. Mol. Pharmaceutics. 20, 6213-6225;
- Гепатит C: решенная проблема?;
- ВПЧ: вирус, вызывающий рак.