-
Статья на конкурс «Био/Мол/Текст»: Сегодня мы поговорим с вами о дрожжах — маленьких организмах, которые плотно осели в жизни человека. В настоящее время их используют не только хозяйки на кухне и виноделы, но и ученые. Эта статья посвящена биотехнологическому методу применения дрожжей, который носит название «дрожжевой дисплей». В основе этой технологии лежит создание генетической конструкции, которая потом загружается в дрожжевую клетку и вовлекается в транскрипцию и последующие процессы. Во многих мокрых лабораториях молекулярные биологи с радостью применяют дисплей для наработки белков и изучения механизмов сложных химических реакций.
-
2135Статья на конкурс «Био/Мол/Текст»: Каждый из нас уже знает о том, что можно создать «минифермы» организмов, которые работают за человека. Например, дрожжи «делают» хлеб, а бактерии — антибиотики. Но потребности человечества становятся все больше, и необходимо синтезировать новые специфические вещества. Именно поэтому в данной статье будет рассказано про бакуловирусную экспрессию, благодаря которой можно синтезировать сложные белковые молекулы, а также показаны ее особенности и применение.
-
Не успев пережить триумф нейросетей (в лице AlphaFold) в предсказании строения белков, структурная биоинформатика взялась за обратную задачу: подбор последовательности для заданной трехмерной укладки. Но решение этой проблемы пока сдерживается фундаментальными ограничениями, присущими и самой программе AlphaFold. В этой колонке я постараюсь объяснить, почему нейросети в структурной биоинформатике не стоит считать панацеей.
-
Статья на конкурс «Био/Мол/Текст»: Аббревиатура «ГМО» продолжает пугать многих людей по всему миру. Возможно, пугает даже больше, чем проблема антибиотикорезистентности бактерий. Что уж говорить о страхе перед вирусами, один из которых буквально несколько лет назад вызвал пандемию? Но что, если эти самые вирусы, да еще и генномодифицированные, смогут помочь нам в борьбе с бактериальными инфекциями? Что, если они окажутся нам не врагами, а друзьями? В этой статье мы разберемся, кто такие вирусы бактерий — бактериофаги, — чем они примечательны и как с их помощью мы, возможно, сможем предотвратить глобальную катастрофу.
-
Пожалуй, самым распространенным «мокрым» методом в биологии является выделение нуклеиновых кислот. Именно от этого первого шага нередко зависит и результат многостадийного эксперимента — скажем, секвенирования важнейшего генома. Сколь разнообразны представители жизни на планете, столь же обширны и подходы к извлечению ДНК и РНК из клеток. Об этом — новая статья цикла «Ультрасовременные методы».
-
912Альберт Ризванов — профессор, Ph.D., доктор биологических наук, член-корреспондент Академии наук Республики Татарстан, директор научно-клинического центра прецизионной и регенеративной медицины института фундаментальной медицины и биологии, заведующий лабораторией OpenLab «Генные и клеточные технологии», руководитель отдела поисковых исследований НОЦ фармацевтики КФУ. Почетный профессор фундаментальной медицины Ноттингемского университета, Великобритания. Заслуженный деятель науки Республики Татарстан. Область научного интереса — регенеративная медицина, генная и клеточная терапия.
-
Бывают такие новости и достижения — с налетом нездоровой сенсации и даже скандала, больше подходящие для первых полос желтой прессы, чем солидных научных биомедицинских изданий. Пересадка головы человека как раз из разряда таких историй. Впервые о пересадке головы я услышала из новостей о Серджио Канаверо — в 2015 году он заявил, что готов пересадить голову российского программиста, страдающего наследственной и быстро прогрессирующей мышечной атрофией, на тело другого человека со смертью мозга. Успешная операция до сих пор не проведена, но СМИ с упоением обсуждали эту возможность, как будто бы больше подходящую для дешевого фантастического романа, чем для реалий серьезных биомедицинских исследований. До того, как открыла книгу Бренди Скиллаче, я не знала, что у Канаверо был именитый предшественник — нейрохирург Роберт Уайт, который задумался о пересадке головы еще в середине ХХ века, задолго до того, как трансплантология стала серьезной и уважаемой дисциплиной, а люди с пересаженными органами имели шанс прожить дольше нескольких месяцев. Книга Бренди Скиллачи повествует именно об этой невероятной истории.
-
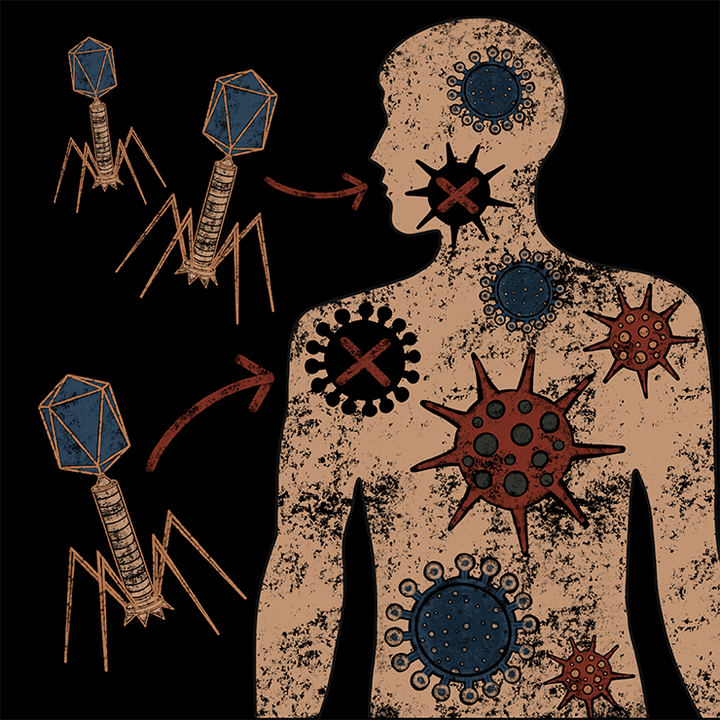
5134В предыдущей статье спецпроекта мы говорили о том, как бактериофагов используют для лечения бактериальных инфекций. Такое применение логически вытекает из самой сути бактериофагов и отражено в их названии. Но «пожиратели бактерий» не так просты. Как мы отмечали в первой статье цикла, они способны проникать в кровь через слизистые оболочки органов, путешествовать по организму человека и взаимодействовать с его собственными клетками. Копнув глубже, ученые открыли многочисленные эффекты фагов, не связанные с уничтожением патогенных микроорганизмов. Например, обнаружили механизмы, работающие против вирусов человека. Это тоже может пригодиться в медицине, так как эффективных противовирусных препаратов до сих пор существует не так много.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин