Лекарство в пробирке: доклинические исследования in vitro
24 сентября 2021
Лекарство в пробирке: доклинические исследования in vitro
- 4442
- 0
- 10
Чем дальше, тем больше доклинические исследования базируются на экспериментах не только на животных, но и на более простых и неодушевленных системах: например, на клетках. Но вытеснит ли когда-нибудь in vitro подход in vivo? Рисунок в полном размере.
иллюстрация Карины Илиопуло
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Доклинические исследования (доКИ) лекарств нужны в первую очередь для подтверждения безопасности новых препаратов, чтобы в последующих клинических исследованиях не пострадали люди. Для этого ученые используют как животные модели, так и культуры клеток. И пусть пока доКИ не обходятся без экспериментов in vivo, работа с клеточными культурами уже сейчас является их неотъемлемой частью. В этой статье спецпроекта о будущем доклинических исследований мы совершим «путешествие к центру организма» — речь здесь пойдет именно о клетках.
Будущее доклинических исследований
Ни для кого не секрет, что биологические исследования и разработка лекарств — сложный и ответственный процесс. При этом в ходе отбора лучших молекул-кандидатов ученые должны заботиться не только о действенности, но и о безопасности новых препаратов. Так до того, как созданное лекарство получит человек, его изучают в других моделях: от компьютерных программ и клеточных культур до разных видов животных.
Спецпроект о доклинических исследованиях (доКИ) стал своеобразным приквелом к циклу статей о клинических испытаниях (КИ): что нужно сделать и изучить перед тем, как проводить клинические исследования с участием людей? Можно ли обойтись без экспериментов на животных? Почему правильные доКИ не менее значимы для разработки лекарства, чем КИ? Мы постараемся в доступной форме осветить сложные вопросы планирования и регулирования доклинических исследований; принципы этичности работы с лабораторными животными; узнаем, когда и чем можно их заменить; и заглянем в ближайшее будущее биомедицинской отрасли.
Независимый рецензент статьи — Георгий Шаронов, с.н.с. Института биоорганической химии. Основной областью научных интересов Шаронова Г.В. является механизм действия рецепторов и передачи сигнала через плазматическую мембрану. В этих исследованиях особое внимание уделяется роли липидов и цитоскелета.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл», ФМИ (PMI Affiliates in Russia), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Каждый из нас еще из школьного курса биологии помнит мантру: клетка — элементарная единица живого. Но в контексте этой статьи для нас важно, что клетки также можно использовать в самых разных научных исследованиях. Все эксперименты с клетками проводят в специальной лабораторной посуде — пробирках или планшетах, — а потому и сами такие исследования носят название in vitro, что дословно переводится «в стекле».
Ученые прошли долгий и тернистый путь, чтобы научиться работать с клетками. С появления первых микроскопов и методов визуализации клеток прошло уже не одно столетие, и за это время был достигнут невероятный прогресс. История культивирования состоит из множества достижений и порой чрезвычайно неслучайных случайностей: чего только стóит открытие Флемингом пенициллина [1] или получение стволовых клеток из соматических (рис. 1).
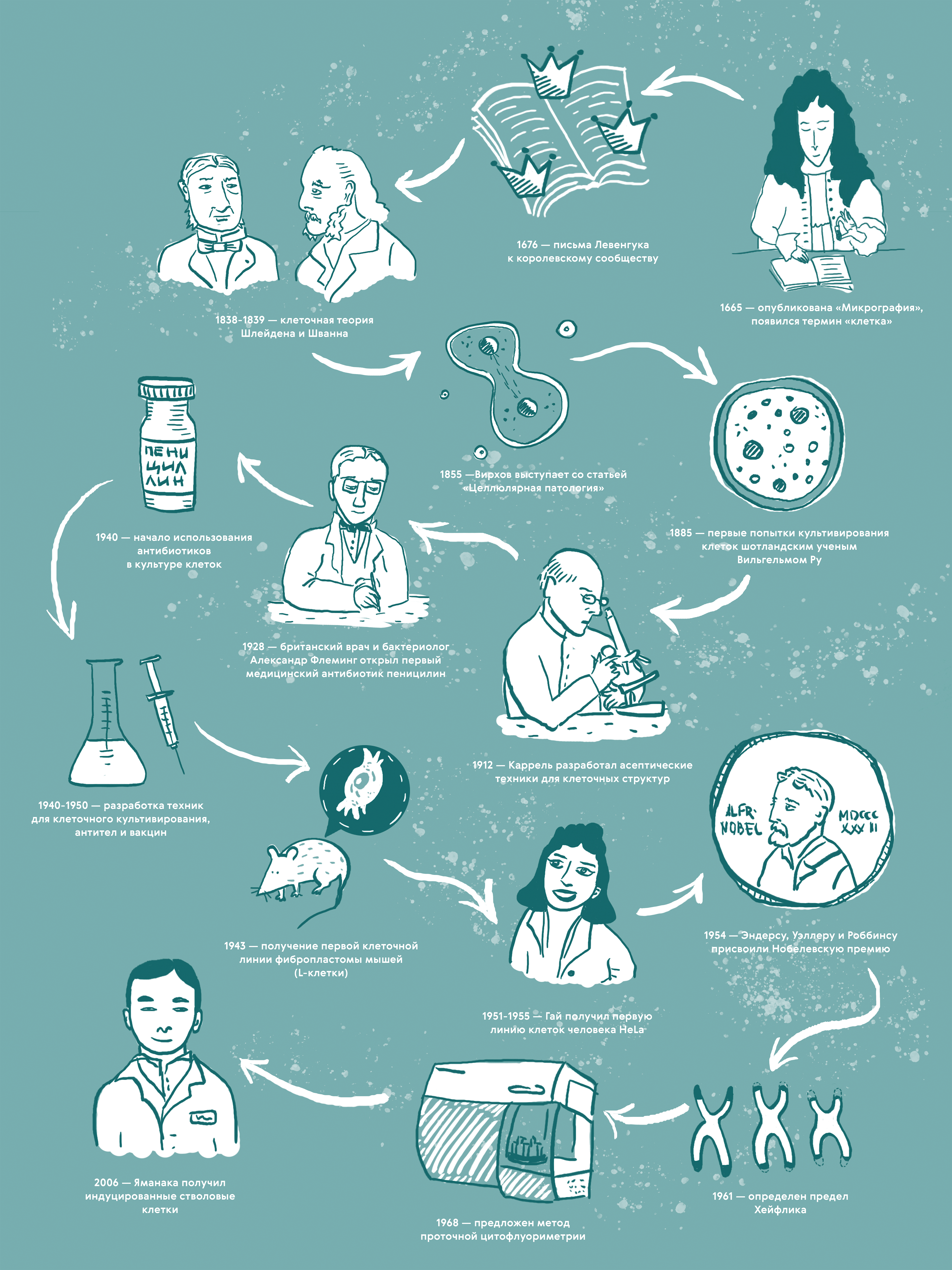
Рисунок 1. История развития клеточных технологий. 1665 год — опубликована книга английского естествоиспытателя Роберта Гука «Микрография», впервые использован термин «клетка». 1676 год — Антони ван Левенгук представил результаты микроскопических исследований в письмах к Королевскому обществу. 1838–1839 гг. — ботаник Маттиас Шлейден и цитолог Теодор Шванн сформулировали клеточную теорию. В 1855 году Рудольф Вирхов выступил со статьей «Целлюлярная патология», в которой сформулировал тезис возникновения клетки путем деления. 1885 год в истории клеточной биологии ознаменован первыми попытками культивирования клеток шотландским ученым Вильгельмом Ру. В 1911–1915 гг. Алексис Каррель разработал технику выращивания культуры тканей куриного эмбриона с использованием плазмы крови и эмбриональной жидкости, что позволило обеспечить рост культуры клеток. В 1928 году произошло открытие первого медицинского антибиотика пенициллина британским врачом Александром Флемингом. С 1940 года ввели применение антибактериальных препаратов в культуре клеток с целью предупреждения контаминации микроорганизмами. В течение следующего десятилетия в 1940–1950 гг. проходила разработка техник для клеточного культивирования и производства вакцин. В 1943 году получена первая клеточная линия, состоявшая из фибробластов мышей (L-клетки). В 1951 году Джордж Гай из биоматериала Генриетты Лакс получил первую линию бессмертных раковых клеток человека HeLa . В 1954 году Томасу Уэллеру и Фредерику Роббинсу присудили Нобелевскую премию по физиологии и медицине за «открытие способности вируса полиомиелита расти в культурах различных типов тканей». Во время вручения премии исследователь из Каролинского института Свен Гард сказал, что «использование культуры человеческих тканей позволило приступить к решению многих проблем вирусологии, что раньше было невозможно из-за отсутствия восприимчивых лабораторных животных». В 1961 году Леонард Хейфлик обнаружил, что клетки человека, делящиеся в клеточной культуре, умирают приблизительно после 50 делений и проявляют признаки старения при приближении к этой границе. В 1968 году Вольфганг Гёде разработал первый инструмент для проточной цитофлуориметрии . 2006 год был ознаменован получением индуцированных плюрипотентных клеток, за что в 2012 году присудили Нобелевскую премию Синъе Яманаке и Джону Гёрдону .
иллюстрация Карины Илиопуло
Эта захватывающая история была пересказана в статье «Бессмертные клетки Генриетты Лакс» [2].
Мы уже рассказывали в больших подробностях о становлении упомянутых тут методик в статьях спецпроекта «12 биологических методов в картинках»: «Микроскопия» [3], «Клеточные технологии» [4] и «Проточная цитофлуориметрия» [5].
Об исследованиях Яманаки и Гёрдона читайте в статьях: «Была клетка простая, стала стволовая» [6] и «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [7].
Сегодня можно без преувеличения сказать, что культуры клеток — это один из мощнейших инструментов, используемых в клеточной и молекулярной биологии. Они обеспечивают ученых и исследователей отличными модельными системами для изучения не только нормальной физиологии и биохимии клеток (в том числе таких процессов как старение), но и воздействия на живой организм лекарств и токсичных соединений, процессов мута- и канцерогенеза. Особое место подходы in vitro занимают в доклинических исследованиях . Именно этому аспекту и посвящена статья, которую вы начинаете читать.
«По классике», в основе доКИ лежат эксперименты с живыми организмами: этот подход носит название in vivo. В этой статье мы собираемся рассказать про более ранний этап, когда работа идет на клетках (in vitro). Но кроме того в доКИ возможно применение и компьютерных подходов и даже искусственного интеллекта (in silico) — об этом мы поговорим в одной из будущих статей спецпроекта. В таком случае исследования проводят на виртуальных органах, системах организма, тканях или просто молекулах при помощи специальных компьютерных программ. Подробнее о «биологии без капли реактива» читайте в статьях «In vivo — in vitro — in silico» [8] и «12 методов в картинках: сухая биология» [9].
А также рекомендуем ознакомиться с классификацией доКИ (например, с делением на регуляторные и поисковые исследования) в первой статье этого спецпроекта: «От живого к неживому. Доклинические исследования сегодня и завтра» [10].
Как клеточные культуры помогают создать новое лекарство
Мало кто из посетителей аптек задаётся вопросом, как лекарства туда попадают и откуда берутся новые препараты, приходящие на смену старым. На самом деле создать и продать фармацевтическое средство очень сложно. Любое новое лекарство, поступающее на рынок, разрабатывается долго и тщательно, — в среднем 12 лет. Большинству людей знакома идея клинических исследований , когда новые препараты тестируют с участием добровольцев для сбора данных об их безопасности и эффективности. Однако от определения соединения, обладающего потенциалом для разработки, до производства препарата, пригодного для клинических исследований, фармацевтические компании проходят долгий и трудный путь, важная часть которого — доклинические исследования (доКИ) , занимающие до половины всего времени разработки .
О том, что такое доКИ и из каких этапов они состоят, мы уже рассказали в первой статье нашего спецпроекта «От живого к неживому. Доклинические исследования сегодня и завтра» [10], с которой мы и рекомендуем ознакомиться читателю. А о том, что происходит дальше, вы можете прочесть в спецпроекте по клиническим исследованиям (например, в статье «С миру по нитке: как соединились компоненты клинического исследования» [11]).
Для тех, кто еще не сориентировался, уточняем: стадии (до)клинических исследований предшествует собственно поиск или разработка лекарственного вещества, о чем мы подробно уже рассказывали и к чему рекомендуем обратиться читателям: «Драг-дизайн. Как в современном мире создаются новые лекарства» [12], «Поиск лекарственных мишеней» [13], «Виртуальные тропы реальных лекарств» [14] и «Три поколения лекарств» [15].
ДоКИ проводят как in vitro (на клетках), так и in vivo (на животных) с целью определить токсикологические и фармакологические свойства будущего лекарства. Поисковые доКИ часто проводят целиком на компьютере (in silico) — например, чтобы идентифицировать молекулы, способные повлиять на работу того или иного молекулярного пути; мы еще поговорим об этом подробнее в четвертой статье спецпроекта.
На первый взгляд всё достаточно просто, но обольщаться не стоит — большинство молекул-кандидатов, найденных на этапе скрининга, отправляются в помойное ведро: в среднем, только одно из 5000 соединений, вошедших в доКИ, становится одобренным препаратом.
Какое место культуры клеток занимают в доКИ? Пока не главенствующее. Несмотря на то, что количество исследований, проведенных в пробирке, стремительно увеличивается, согласно современному законодательству, доКИ не могут полностью проводиться in vitro. Их основу в настоящее время составляют модели in vivo как наиболее релевантные и надежные, хотя подход in vitro крайне привлекателен с точки зрения этики и экономической выгоды. Очевидно, что выращивать клетки куда менее затратно и более гуманно, чем мышей, кроликов и тем более — собак или приматов (о гуманности и этичности испытаний на животных см. врезку). А ведь для исследований «в стекле» можно брать и человеческие клетки, и даже целые ткани.
Помимо подтверждения свойств конкретных молекул (что осуществляется, как правило, в рамках регуляторных доКИ), клеточные модели активно применяют и в поисковых (фундаментальных) работах. Например, созданы клеточные линии для изучения Т-клеточного ответа [16], которые можно использовать в широчайшем спектре биомедицинских разработок: от новых вакцин до легендарной CAR-T-терапии [17].
Какие клетки используют в доКИ: клеточные линии
В доклинических исследованиях используют не отдельные клетки, а их культуры, выделенные из живых организмов (например, из человека, растения или животного) и помещенные в искусственную среду, где они могут расти какое-то время.
Свежевыделенные клетки, которые прошли один цикл роста и готовы к переносу в новый субстрат, называют первичной культурой. Как только клетки формируют полный монослой и пересеваются из нее, первичная культура становится клеточной линией, где со временем начинают главенствовать наиболее сильные клетки-представители. Этим обусловлена повышенная однородность клеток внутри линий. Если же клетки генетически идентичны (например, получены путем клонирования), речь будет идти уже не просто о линии, а о клеточном штамме.
По-другому, пассируются, то есть попадают в новую среду, дающую им возможность расти дальше.
Все клеточные линии принято также делить на конечные и непрерывные (они же — бессмертные). Первые способны делиться в искусственной среде ограниченное количество раз, в ходе развития стареют и затем — гибнут. С непрерывными всё куда интереснее. В процессе роста сами по себе или под воздействием внешних факторов они трансформируются, после чего могут делиться бесконечно долго. К непрерывным линиям относятся также и раковые клетки, и стволовые. Какие же клетки лучше и у кого их берут? Давайте разбираться.
Первичные vs перевиваемые — какие клетки лучше?
Первичные культуры клеток получают непосредственно из живого организма. Например, забор материала могут проводить во время оперативных вмешательств. Выделение самих клеток из образцов ткани осуществляется в стерильных ламинарах, которые обеспечивают определенный уровень биобезопасности (BSL 2) и соблюдение асептических условий работы с культурой. Как только их пассируют (пересевают), они перестают быть первичными, превращаясь в клеточную линию. Так, источником бессмертных и диплоидных (конечных) клеточных линий являются именно первичные культуры клеток.
Хотя принято считать, что первичная культура лучше других моделирует организм, она имеет и свои недостатки: прежде всего, такие культуры недолговечны и подвержены контаминации вирусами и дифференцировке, в результате которой утрачивают свой фенотип. Кроме того, подготовка первичных культур трудоемка, требует продвинутых навыков культивирования, а поддерживать их in vitro можно лишь очень недолгое время, по истечении которого морфология клеток меняется, они стареют и погибают .
Этот процесс также носит название репликативного старения. Клетки, полученные из первичных культур, способны делиться ограниченное число раз из-за постепенного сокращения теломер (специальных участков ДНК на концах хромосом, защищающих клетки от мутаций) (рис. 4). В конце концов, теломеры и вовсе исчезают, а клетка активирует программу апоптоза — самоубийства в миниатюре [20]. Количество делений до «момента Х» носит название предела Хейфлика: обычно это 50–52 деления.
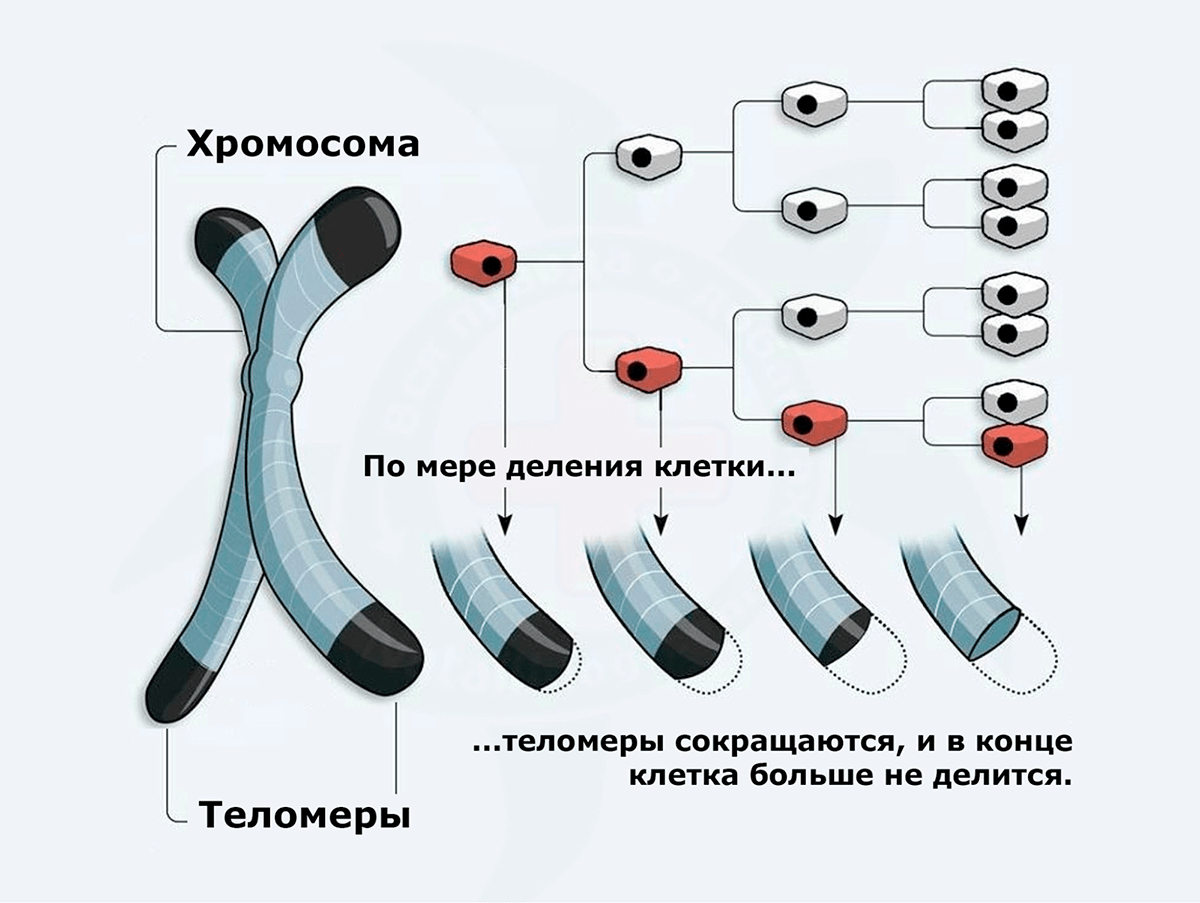
Рисунок 4. Теломеры: что наши клетки теряют с каждым поколением?
Зачем же нужны такие клетки, которые со 100%-ной вероятностью погибнут? Срок годности у них действительно небольшой, однако мы уже говорили, что в течение своей недолгой жизни такие клетки лучше всего сохраняют характеристики, которыми они обладали непосредственно в организме, то есть in vivo. Это значит, что с помощью первичных культур, взятых у человека, можно получать более релевантные данные, чем при работе на клетках животных. Это и есть самый важный и неоспоримый плюс первичных культур.
Бессмертные (или непрерывные) клеточные линии способны к делению вне организма неопределенно долгое время — не зря их называют иммортализованными, или постоянными. Обычные клетки не обладают способностью к бесконтрольному постоянному делению, так откуда берутся постоянно делящиеся клеточные линии? Хотя такое перерождение может происходить с клетками и само собой (например, после обработки мутагенами и вирусами), при работе с клеточными культурами исследователи добиваются этого намеренно.
В иммортализованных клеточных линиях лимит Хейфлика преодолевают, искусственно активируя теломеразу — фермент, удлиняющий теломеры и позволяющий клеткам избежать судьбы своих стареющих родственников. Практически клетки становятся бессмертными (то есть приобретают способность делиться бесконечно долго).
Кстати, теломераза активна и у раковых клеток. Однако их теломеры могут удлиняться и другим путем — с помощью гомологичной рекомбинации. Мы писали об этом в статье «Теломеры и новые мишени протоонкогенной терапии» [23].

Рисунок 5. Генриетта Лакс умерла от рака, но по стечению обстоятельств стала невольным источником биоматериала, давшего начало культуре клеток HeLa, давно применяемой в научных целях.
Непрерывной считается культура клеток, которая пассировалась не менее 70 раз с трехдневными промежутками. Клетки таких культур идентичны по форме и обычно приобретают гетероплоидный набор хромосом (число хромосом любое, кроме нормального), что характерно для опухолей. Иммортализованные клеточные линии получают как из здоровых тканей животных или человека, так и из опухолевых. Однако стоит отметить, что некоторые из них могут обладать онкогенной активностью, и это ограничивает их применение. Все непрерывные клеточные линии хорошо охарактеризованы и содержатся в специальных банках клеток.
При разговоре о бессмертных культурах клеток нельзя не упомянуть знаменитую клеточную линию НеLа — одну из наиболее известных и часто используемых перевиваемых культур. HeLa получил в феврале 1951 года Джордж Гай от больной раком шейки матки женщины по имени Генриетта Лакс, почившей спустя восемь месяцев. В результате наблюдений Гай отметил, что нормальные клетки женщины умирали, а раковые активно делились бесконечное количество раз. В лаборатории Гая культура изучаемых раковых клеток была названа HeLa — по инициалам пациентки (рис. 5). Подробнее эту захватывающую историю можно прочитать в статье «Бессмертные клетки Генриетты Лакс» [2].
Иммортализованные клеточные линии имеют ряд недостатков, поскольку сильно отличаются от клеток в ткани (начать хотя бы с числа хромосом). Однако они просты в использовании, гомогенны и хорошо охарактеризованы — и потому часто используются в доКИ.
Диплоидные (конечные) культуры клеток получают из клеточных линий первичных культур, выделенных из тканей эмбриона человека и животных: они, в отличие от бессмертных линий, имеют двойной набор хромосом (точно такой же, как у донора). В первых 50–60 пассажах эти клетки сохраняют диплоидность и жизнеспособность и редко «подхватывают» вирусы, а поэтому их широко используют в медицине и биологии. Также большой плюс таких культур — неонкогенность. Не зря изначально их создавали для производства вакцин, которое требовало много безопасного субстрата для размножения вакцинных штаммов вирусов.
Нужно ли готовить клетки самим?
Очень часто для доКИ клетки закупают у специализированных компаний, занимающихся продажей клеточных линий, реактивов и приборов для лабораторий. «Покупные» культуры обычно поставляются в двух видах: замороженными или во флаконе с монослоем клеток. При работе с приобретенными культурами крайне важно поддерживать стерильность, так как новая культура может поставляться без антибиотиков, а потому легко заражаться.
Законсервированные банки перевиваемых клеток часто имеют двухуровневую организацию и включают главный (ГБК) и рабочий (РБК) банки; такой дизайн позволяет создавать стабильные во времени линии клеток для практических применений вроде исследований и фармацевтического производства. Главный банк — это своеобразный неприкосновенный запас непрерывных клеточных линий, который разделен на несколько частей (аликвот) и хранится в жидком азоте. При необходимости пробирку с клетками из ГБК размораживают; клетки, содержащиеся в ней, культивируют; и уже из них формируют рабочий банк клеток (состоит из 50–100 криопробирок), из которого можно брать необходимые культуры для использования в доКИ .
Более подробно ознакомиться с системой создания банков клеток и их практического применения в промышленности можно в статье «Наработка антител для доклинических и клинических испытаний» [24].
Помимо коммерческих банков клеток, существуют еще коллекции, играющие более широкую роль: это не столько хранилища, пригодные для быстрого коммерческого использования, сколько собрания всех описанных клеточных линий. Так, в России с 1978 г. существует на базе девяти организаций коллекция клеточных культур, предназначенная для сбора клеточных линий; их криоконсервации; паспортизации (рис. 6); депонирования; создания информационного банка данных; и распространения клеточных образцов:
- Коллекция культур клеток позвоночных. Институт Цитологии РАН, г. С.-Петербург.
- Коллекция клеточных линий человека и животных для исследований в области вирусологии. НИИ гриппа РАМН, г. С.-Петербург.
- Коллекция перевиваемых соматических клеток позвоночных. НИИ вирусологии им. Д.И. Ивановского РАМН, г. Москва.
- Коллекция перевиваемых соматических клеток позвоночных медицинского назначения. Екатеринбургский НИИ вирусных инфекций. МЗ РФ, г. Екатеринбург.
- Коллекция перевиваемых соматических клеточных культур сельскохозяйственных и промысловых животных. ГНУ ВНИИ экспериментальной ветеринарии им. Я.Р. Коваленко. Россельхозакадемия, г. Москва.
- Коллекция соматических клеток человека от больных наследственными заболеваниями. Медико-генетический научный центр, РАМН.
- Всероссийская коллекция постоянных линий клеток беспозвоночных. Институт общей генетики им. Н.И. Вавилова, РАН, г. Москва.
- Всероссийская коллекция клеток высших растений. Институт физиологии высших растений им. К.А. Тимирязева, РАН, г. Москва.
- Коллекция генетически трансформированных pRi корней высших растений. Институт высших растений им. К.А. Тимирязева, РАН, г. Москва.
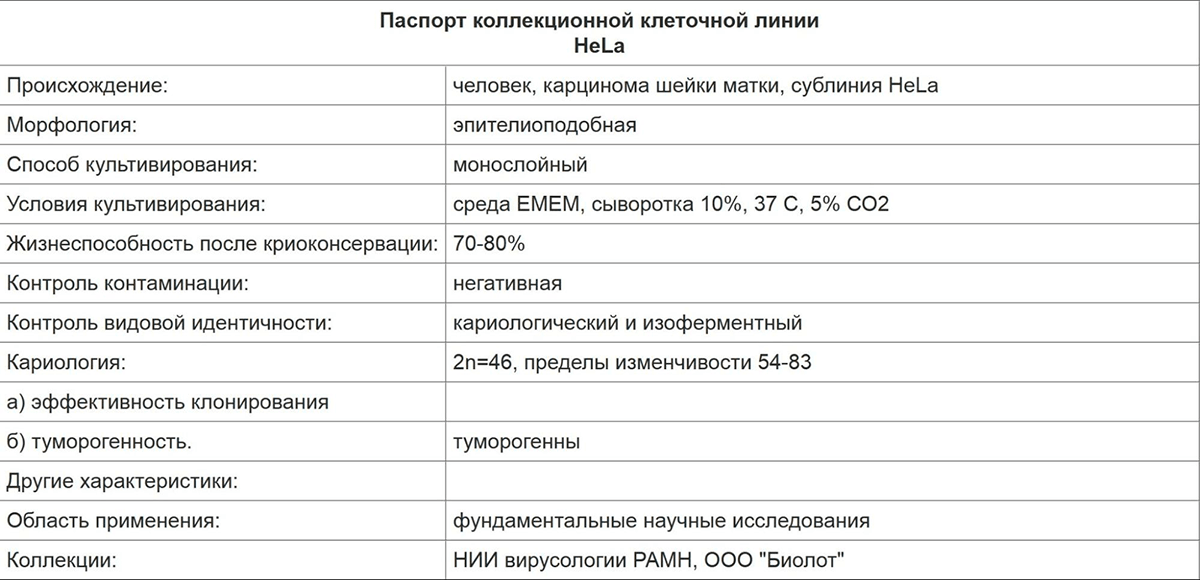
Рисунок 6. Паспорт клеточной линии карциномы шейки матки человека HeLa (Российская коллекция клеточных культур позвоночных). В паспорте указывается информация об истории культивирования, аббревиатура клеточной линии, ее происхождение, морфология клеток в культуре, жизнеспособность после криоконсервации, определяемая на 0-м пассаже, и контроль контаминации культуры микроорганизмами.
Какие клетки можно использовать в доКИ?
Для проведения доКИ можно использовать как первичные, так и иммортализованные (перевиваемые) культуры клеток. Обычно это уже готовые клеточные линии, хранящиеся в специальных банках, для которых описаны надежные и валидированные методы работы с ними. Первичные культуры используют реже — срок их жизни ограничен, а кроме того, в таком случае приходится доказывать пригодность этой линии для получения релевантных и воспроизводимых результатов. Тем не менее выбор клеток всегда зависит от множества факторов, в том числе от природы заболевания, против которого разрабатывают лекарство, и от свойств самого лекарства. Полностью стандартизировать подходы к разработке лекарств невозможно, ведь ученые каждый раз работают над новой, уникальной задачей. Однако используемая линия всегда должна удовлетворять общим требованиям, предъявляемым к доклиническим моделям.
Куда более строгие стандарты накладывают на клеточные линии для производства лекарств. Здесь все правила сформулированы Международной конференцией по гармонизации технических требований к регистрации лекарств для медицинского применения (ICH) в релевантном руководстве ICH, руководстве ICH по вирусной безопасности, руководстве получения и установления характеристик клеточных субстратов (ICH Q5D), а также в правилах проведения исследований биологических лекарственных средств Евразийского экономического союза.
У кого берут клетки для доклинических исследований?
Для проведения доКИ используют множество разных клеточных линий, материал для которых берут у человека, других млекопитающих, рыб и даже насекомых (табл. 2). Одни из первых клеток, использованных в доКИ, получили из почки африканской зеленой мартышки: их использовали для разработки инактивированной полиомиелитной вакцины [25]. Позже в работу пошли клетки из куриных эмбрионов, почек собак, грызунов (в основном кроликов и хомяков) и т.д.
| Вид | Орган/ткань | Название клеточной линии |
|---|---|---|
| Крыса | Гепатома | HTC |
| Невринома Гассерова узла | NGUK-1 | |
| Мышь | Гепатома | BWTG 3, MH-22a |
| Глиобластома | EPNT-5 | |
| Лимфома | L 1210, EL-4 | |
| Миелома | Clone M-3, NSO/1 P3/NS1/1-Ag4-1(NS-1), P3X63Ag8.653 | |
| Мышцы скелетные, нейробластома | Sp2/0-Ag14, C2C12, NB41A3 Neuro-2a | |
| Рабдомиосаркома | NB41A3 Neuro-2a, A-7, MCH-7, MCH-82 | |
| Саркома | J-774 | |
| Соединительная ткань | A-9, L TomNIIVS | |
| Фибробласты | McCoy B | |
| Фибросаркома | Wehi 164 | |
| Обезьяна (африканская зеленая мартышка) | Почка | BGM, BSC-1, CV-1, Vero, Vero (V), Vero 76, Vero C1008 |
| Собака | Почка | MDCK (NBL-2) MDCK, клон L-9 |
| Человек | Амнион | AMN |
| Гипернефрома | HN | |
| Глиобластома | GL-6, T 98G | |
| Кишечник, аденокарцинома | Caco-2, HuTu 80, SW 837 | |
| Кишечник, карцинома | COLO 320, HSR, HT-29 | |
| Кожно-мышечная ткань нормального эмбриона | ChEF 392/1 (ЧЭФ 392/1) | |
| Легкое, карцинома | А 549 | |
| Легкое эмбриона | ФЛЭЧ 385/13, ФЛЭЧ 985/12, ФЛЭЧ 997/11, ФЛЭЧ 1097/30, ЛЭЧ-4(81) | |
| Легкое эмбриона (трансформированные клетки) | WI-38 VA 13 subline 2RA | |
| Лейкемия В-лимфобластная | CCRF-SB | |
| Лейкемия миелогенная | K-562, KG-1, THP-1 | |
| Лейкемия промиелоцитарная | HL-60 | |
| Лейкемия Т-лимфобластная | Jurkat, MOLT-3, MOLT-4, Т-1387 | |
| Лейкоциты | RPMI 1788 | |
| Лимфома Беркитта | Daudi NAMALVA P3H3, P3HR-1(P3J-HR1K), Raji | |
| Матка, карцинома | HeLa gniiem, HeLa-КD, HeLa S 3, HeLa TK, HeLa v, М-HeLa, М-HeLa клон 11 | |
| Мезенхимные стволовые клетки: костный мозг эмбриона, мышца конечности эмбриона, крайняя плоть ребенка | FetMSC, M-FetMSC, FRSN, FRSN-1 | |
| Миелома | RPMI 8226, IM-9 | |
| Молочная железа, аденокарцинома | MCF-7, BT-20 | |
| Молочная железа, карцинома | ZR-75-1 | |
| Мочевой пузырь, карцинома | Т-24 | |
| Нейробластома | IMR-32, SK-N-MC | |
| Остеосаркома | MG-63, U-2 OS, Hos (TE85, clone F5) | |
| Печень, аденокарцинома | SK-HEP-1 | |
| Печень, карцинома | Hep G2 | |
| Поджелудочная железа, аденокарцинома | AsPC-1, Capan-2 | |
| Подкожно-жировая клетчатка | ATRC-70 | |
| Рабдомиосаркома | RD | |
| Фибросаркома | HT-1080 | |
| Эпидермис, карцинома | A 431 | |
| Эмбриональные стволовые клетки | SC5 | |
| Яичник, тератокарцинома | PA-1 |
Каковы же требования к донорам клеток? При заборе клеток у человека важно знать его возраст, пол, физическое состояние, отсутствие инфекций (ВИЧ, гепатиты В и С, сифилис), также необходимо указывать этническое и географическое происхождение донора. Например, при использовании диплоидных культур фибробластов не просто важно, а необходимо учитывать возраст человека, так как от этого сильно зависит продолжительность жизни клеток in vitro. При использовании линии животных клеток значение имеет вид, порода, условия разведения и так далее.
Проверка лекарства in vitro. Возможно ли это?
Остановимся подробнее на оценке безопасности новых лекарств на моделях in vitro — фармакологических и токсикологических исследованиях. Более подробно обо всех видах тестирования, принятых в доКИ, можно прочитать в первой статье спецпроекта — «От живого к неживому. Доклинические исследования сегодня и завтра» [10].
Фармакология in vitro: фармакодинамика и фармакокинетика
Фармакологические исследования помогают понять, что происходит с лекарством при попадании в организм (фармакокинетика) и с организмом — при приеме этого препарата (фармакодинамика).
Фармакодинамика может быть:
- первичной — оценивает влияние препарата на терапевтическую мишень;
- вторичной — изучает механизм действия лекарства, не связанный с мишенью и не запланированный при его разработке.
На этапе фармакодинамических исследований оценивают перекрестное взаимодействие лекарств и их совместимость. Например, так установили, что антимикробные препараты могут усиливать действие антибиотиков [26]. Этим часто пользуются в современной медицинской практике. Например, стоматологи пациентам с хроническим пародонтитом наряду с антибактериальными препаратами (чаще пенициллинового ряда) назначают и метронидазол.
В исследованиях первичной фармакодинамики модели in vitro обычно используют, когда хотят изучить связывание нового вещества с молекулярной мишенью, а также оценить пролиферацию клеток. Так, например, в ходе доКИ комбинированного контрацептивного препарата «Зоэли» было изучено сродство действующего вещества к рецепторам прогестерона. Причем эти исследования проводились на различных чувствительных к гормонам клеточных линиях, источником которых были крысы, кролики и человек (HeLa). В итоге установили антиандрогенную активность препарата, подтвердив это позже в исследованиях in vivo. Таким образом исследования на клетках были релевантны и показали, что препарат выполняет свою функцию в полном объеме.
Исследования вторичной фармакодинамики, напротив, могут быть нацелены на то, чтобы доказать, что препарат не обладает активностью на ненужные мишени: ферменты, рецепторы и ткани в целом. Так, доКИ in vitro известного гипотензивного препарата «Эдарби» показали, что он не только блокирует связывание ангиотензина II (этим и вызван его эффект), но и повышает чувствительность тканей к инсулину пропорционально дозе. Это значит, что при назначении препарата пациентам, страдающим диабетом, необходимо контролировать уровень глюкозы и при необходимости корректировать дозировку гипогликемических средств.
В область фармакодинамики входит и фармакологическая безопасность, когда исследуют нежелательные эффекты от приема препарата на физиологию. Исследования затрагивают воздействие препарата на сердечно-сосудистую, дыхательную, центральную нервную системы (это обязательно для любого препарата), желудочно-кишечный тракт, выделительную и прочие системы. Крайне важно пройти эти тесты в доКИ, ведь будет, мягко говоря, обидно вылечить пациента от одного заболевания, но при этом вызвать другое.
Модели in vitro используют в основном для оценки кардиотоксичности. В качестве источника клеток используются волокна Пуркинье и изолированные препараты сердца, на которых исследуют связывание препарата с калиевыми каналами hERG сердца. Блокировка этих каналов приводит к смертельно опасным последствиям: нарушению реполяризации миокарда, увеличению продолжительности QT-интервала и желудочковой тахиаритмии [27]; так что ненароком «выключить» их — значит убить многих пациентов.
В рамках фармакокинетических исследований с помощью моделей in vitro чаще всего оценивают метаболизм препарата. В основном он происходит в печени — в гепатоцитах, ведь в их микросомах содержатся основные ферменты лекарственного метаболизма (цитохром Р450, трансферазы, флавин-содержащие монооксигеназы). Изучение метаболизма тестируемого вещества можно провести на первичной культуре гепатоцитов, срезах печени или же на перевиваемых культурах (лучше всего отображают метаболизм клеточные линии гепатомы человека).
- Первичные культуры и гистологические срезы получают после операций.
- Среди перевиваемых клеточных линий наиболее подходящей считается HepaRG [28], выделенная из печени женщины, больной гепатитом С и циррозом. Несмотря на анамнез пациентки, эти клетки способны к дифференцировке в зрелые гепатоциты, которые могут сохранять свои функции в течение нескольких недель [29].
- Для оценки зависимости «доза—эффект» (важно для подбора дозировки) используют гепатоциты крыс и соответствующие животные модели.
Изучение токсичности на моделях in vitro
Исторически тесты токсикологической безопасности проводят на теплокровных животных. Чтобы оценить воздействие одного вещества на организм, ученым, как правило, требуются сотни подопытных животных, а стоимость такого «удовольствия» доходит до 1 млн долларов. Не удивительно, что исследователи пытаются максимально сократить количество используемых лабораторных животных и заменить их моделями in vitro. В настоящее время даже созданы специальные организации, контролирующие внедрение новых методов — например, Европейский центр по утверждению альтернативных методов.
На клеточном уровне можно выделить три основных механизма токсического действия лекарственных препаратов: повреждение мембран клеток, нарушение метаболизма и нарушение деления клеток. Все эти механизмы можно оценить на моделях in vitro. Исследование токсичности можно проводить как на первичных, так и на перевиваемых культурах клеток.
Из постоянных клеточных линий человека используют: клетки немелкоклеточного рака легких, эпителиальные клетки синовиальной жидкости, карцинома печени, глиобластома-астроцитома, аденокарцинома толстого кишечника, Т-клеточная лимфома, карцинома матки, гепатома печени, колоректальная аденокарцинома человека и др. Распространенные животные культуры клеток включают: фибробласты мышей, клетки опухоли Эрлиха, клетки гепатомы крыс и т.д. Среди первичных культур чаще используют гепатоциты для оценки гепатотоксичности. Как правило, применяется та клеточная линия, которая содержит клетки органа, оцениваемого по токсическому эффекту тестируемого вещества (табл. 3) [30].
| Токсический эффект | Клеточная культура |
|---|---|
| Цитотоксичность | Фибробласты человека и мыши, клетки эпителия, HeLa — карциномы матки и другие |
| Нарушение функции органов дыхания | Клетки карциномы легких SQ-5 |
| Кардиотоксичность | Эндотелиоциты, кардиомиоциты |
| Нейротоксичность | Нейроны куриного эмбриона, клетки астроглии крыс, клетки NB-1 — нейробластомы |
| Гепатотоксичность | Hep-G2 с гепатомы человека, клетки гепатомы крыс HTC, гепатоциты человека, гепатоциты крыс и мышей |
| Гематотоксичность | HL-60 — лейкозные лейкоциты, клетки крови, эритроциты периферической крови мышей BALB |
| Нефротоксичность | Эпителиоидные клетки эмбриональной почки, клетки почек быка MDBK |
| Иммунотоксичность | Клетки тимуса, селезенки, клетки крови |
| Дерматотоксичность | Эмбриональные фибробласты, кератиноциты человека, кератиноциты кролика и крысы |
Для исследования цитотоксичности на клеточной линии проводят несколько тестов, основанных на подсчете количества клеток, оценке их метаболизма и целостности мембраны. Наверное, проще и эффективнее для изучения метаболизма препарата — микротитрационный МТТ-тест (рис. 7). С его помощью можно наглядно оценить жизнеспособность клеток по ярко-фиолетовой окраске, которую приобретают живые и здоровые клетки, окисляющие своими бодрыми митохондриями добавляемый в среду тетразол. Если клетка жива и ее митохондрии активны, окраска будет яркой, и чем активнее метаболизм, тем насыщеннее цвет.
Более подробно с этой и другими методиками можно ознакомиться в статье «Ты не пройдешь. В поисках идеальной системы для доклинического тестирования противоопухолевых препаратов» [31].
Для тех же целей можно измерить активность лактатдегидрогеназы (ЛДГ) в среде. Почему ее? ЛДГ — это внутриклеточный фермент, содержащийся практически во всех клетках человека и животных, а поэтому при нарушении клеточной мембраны (например, из-за повреждения токсином) ЛДГ будет выходить из клеток наружу. Это довольно простой и наглядный тест, позволяющий оценивать «самочувствие» клеток в реальном времени.
Еще один путь — окраска клеток трипановым синим (рис. 8). Этот краситель не проходит через мембрану, однако если та повреждена — краска проникает в ядро и расцвечивает его оттенками синего, показывая, что клетка «прохудилась» и, скорее всего, уже нежизнеспособна.
Кроме этого часто применяют непосредственный подсчет клеток и колоний. Мертвые клетки открепляются от дна культурального флакона, и их можно довольно легко подсчитать в бинокуляр. Если после воздействия препарата клетки «поплыли» — это не лекарство, а яд.
2D- и 3D-модели культур клеток
Традиционно клеточные линии культивируют в один слой в чашке Петри или на планшете (рис. 9), погруженными в питательную среду. Культура клеток получается однослойная, а чашка (стеклянная или пластиковая) служит субстратом для закрепления. Монослойное культивирование широко используются в биомедицинских исследованиях, в частности, с целью определения митотического потенциала клеток, изменения их функциональной активности под воздействием специфических факторов, для сравнения физиологических и биохимических характеристик клеток, полученных из нормальных и опухолевых тканей и, конечно, для проведения доКИ. Клетки, культивированные в монослое, морфологически отличаются от клеток in vivo: они более плоские и растянутые, а это может заметно изменить внутриклеточные процессы (рис. 10) [32].
Клетки можно выращивать не только в монослое, но и в суспензии, когда они просто плавают в культуральной среде внутри биореактора — это идеально подходит для клеток крови, которые в организме существуют ровно в таком состоянии. Биореакторы бывают нескольких типов: с механическим перемешиванием; газо-вихревые реакторы, в которых всё перемешивает поток воздуха, продуваемый через среду; а также комбинированные. Суспендирование обеспечивается разными приемами, включая покрытие стенок реакторов гидрофобным материалом (чтобы клетки не прилипали) и использование питательной среды без ионов кальция (оказывается, кальций способствует адгезии клеток к субстрату).
3D-культуры
Как ни крути, 2D-культуры остаются плоскими, не отражающими всей совокупности межклеточных взаимодействий в организме. Так же картина, в сравнении со скульптурой, позволяет взглянуть лишь с одной стороны. В последнее время начинают использовать 3D-культуры, более сложные в обращении, но гораздо более реалистичные — что важно в том числе и для целей доКИ.
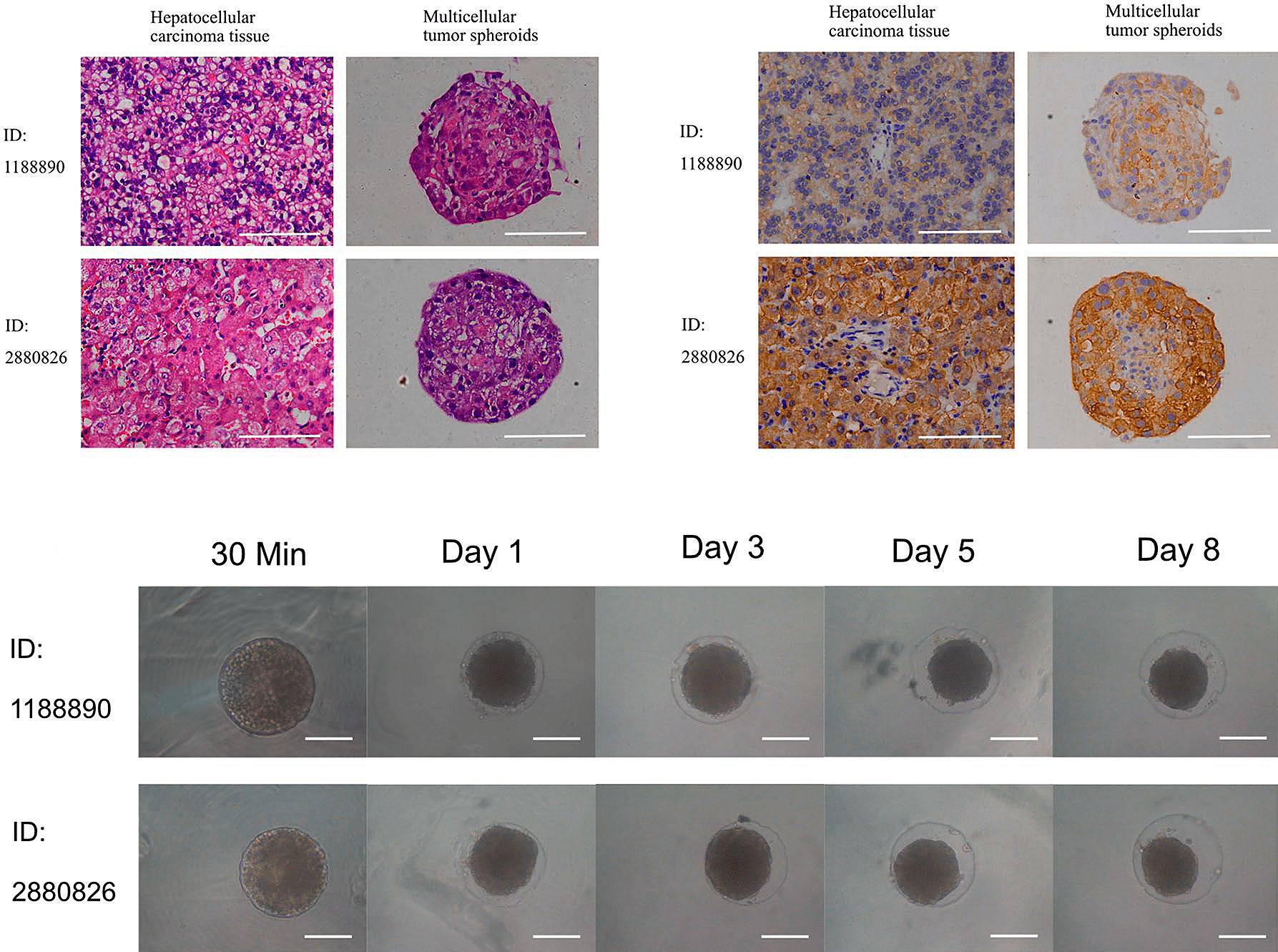
Базовая 3D-культура — это тканевые сфероиды (рис. 11): сгустки из живых клеток (1000 — 20 000 штук) диаметром 200–300 мкм [34]. Культивирование проводят либо в луночных планшетах с агаром, либо методом висячей капли, либо же применяют специальные (правда, довольно дорогие) планшеты. Сфероиды можно «строить» на специальном каркасе (скаффолде), имитирующем внеклеточный матрикс, куда засеваются клетки. Сфероиды часто используют в доклинических исследованиях как модели бессосудистых опухолевых узлов, микрометастазов или участков солидных опухолей (рис. 12).
О том, как именно создают сфероиды, можно прочитать в статье «Тумороиды — микроопухоли в пробирке» [35].
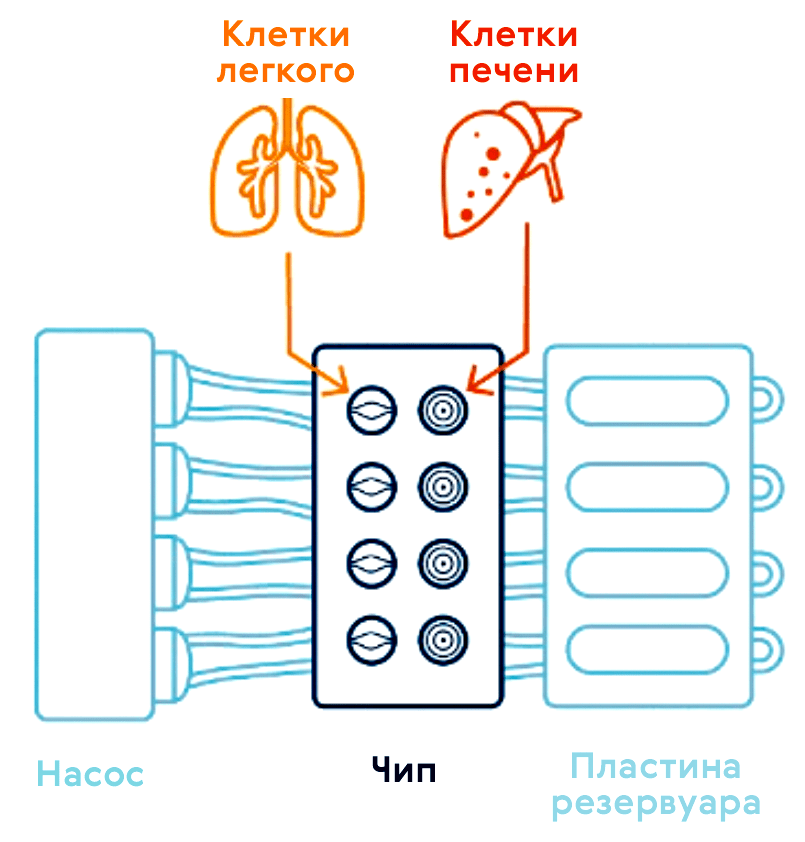
Существует еще одна многообещающая 3D-модель — органы-на-чипе (рис. 13 и 14; видео 1) [37], возникающая в наши дни на стыке микрофлюидики и клеточных технологий. Орган-на-чипе позволяет проводить реалистичные испытания новых лекарств и может предсказывать реакцию на множество стимулов, включая воздействие лекарственных препаратов и окружающей среды.
Видео 1. Орган на чипе — 3D-микрофлюидное устройство, содержащее каналы, заполненные живыми клетками и имитирующее работу системы органов человека.
Технологическая основа органа-на-чипе (рис. 15) — 3D-микрофлюидное устройство для культивирования клеток, разработанное для имитации физиологии органа [39]. Крошечные каналы позволяют нано-объемам жидкости транспортировать и распределять питательные вещества или лекарства по клеткам, населяющим микроскопические камеры девайса. Одна из разновидностей — опухоль-на-чипе, на которой удобно проводить скрининг препаратов [40].
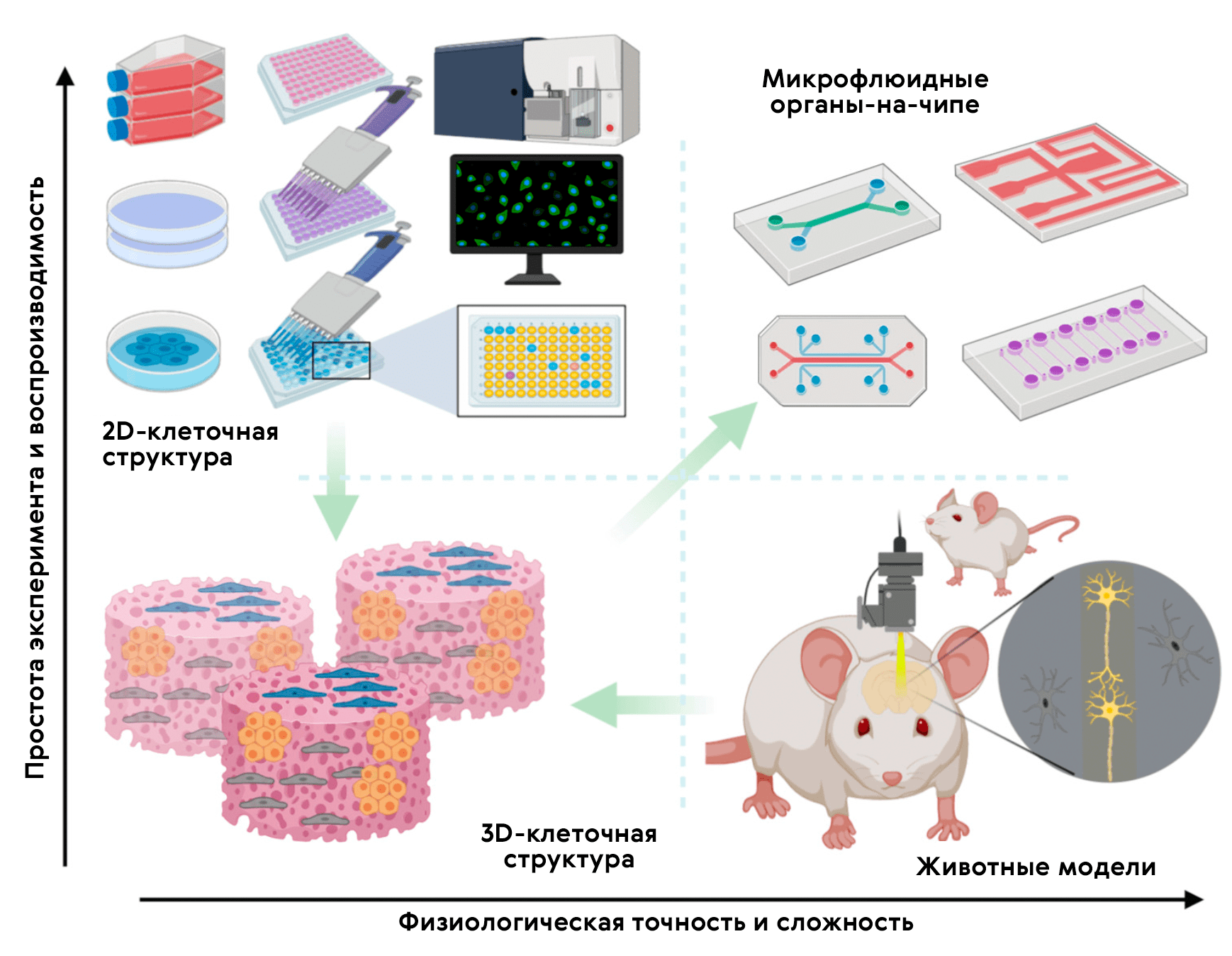
Рисунок 15. Место органов-на-чипе в арсенале доклинических исследований. 2D-культуры in vitro предлагают быстрый и воспроизводимый способ анализа лекарственного препарата; однако им не хватает 3D-организации среды тканей. Стандартные 3D-культуры клеток могут обеспечить объемную среду для 3D-культивирования, но всё равно не позволяют контролируемо воспроизвести физиологию и патологию человеческого организма in vivo. Модели на животных позволяют проводить релевантный анализ in vivo, однако различия человека и прочих животных снижают точность и воспроизводимость экспериментальных результатов. Микрофлюидные органы-на-чипе позволяют прицельно культивировать клетки в органотипической микроархитектурной среде, представляя простую, но довольно физиологичную платформу не только для исследования биологии человека, но и для проведения доКИ.
Недавно органы-на-чипе применили и в персонализированной медицине , которая направлена на подбор лучших препаратов и их дозировок для конкретного пациента. Метод оказался здесь весьма кстати, ведь с его использованием можно воспроизвести физические и химические аспекты состояния каждого человека. Специализированные клетки в данном случае можно получить, выделяя первичные из организма пациента или же превращая их из соматических в индуцированные плюрипотентные стволовые клетки, а затем преобразуя в необходимый тип клеток, которые уже можно культивировать на микрофлюидном устройстве и подвергать воздействию различных доз препарата. Исследуемое вещество в систему можно вводить с циркулирующей жидкостью, чтобы максимально точно отразить, что будет происходить в организме.
Более подробно ознакомиться с методикой органа-на-чипе в рамках доКИ можно будет в следующей статье. А узнать про персонализированную медицину и органы-на-чипе в любых их проявлениях можно в следующих статьях «От медицины для всех — к медицине для каждого» [41], «Фармакогеномика: изучение генов на службе персонализированной медицины» [42], «Человек на чипе» [37], «Органы из лаборатории» [43].
Когда для 2D-культур включается красный свет?
Мы уже сказали, что монослойные культуры — пока что самый частый, хотя во многих случаях и не совсем адекватный выбор для доКИ. Они просты в использовании (замена среды и пассировка не вызывают трудностей), однако совершенно не повторяют трехмерную организацию живых тканей, а потому уже на старте снижают достоверность исследований in vitro [45]. И если в суспензиях еще возможно использование сокультур (когда к исследуемым клеткам добавляют другие, имитирующие расположение в натуральной ткани) [46], то для монослоя такой возможности нет вообще.
Когда это важно? Например, при разработке противоопухолевых препаратов, где монослой может дать попросту ложные результаты. Дело в том, что в организме опухоль — это очень плотный сгусток клеток, в центре которого постоянный дефицит кислорода и питательных веществ, но и лекарство туда проникает гораздо хуже (а значит, и эффекта от лечения может не быть). В монослое же все клетки одинаково доступны, и эта разница здесь совершенно принципиальна. Кроме того, клетки опухоли гетерогенны (в один момент времени находятся на разных стадиях клеточного цикла), что также меняет восприимчивость к лекарству. 3D-культуры позволяют создать нужные градиенты веществ и лекарства, а потому именно их предпочтительно использовать для поиска противоопухолевых лекарств [47].
Подтвердить это можно работой польских исследователей, которые in vitro воздействовали противоопухолевым препаратом — 5-фторурацилом — на раковые клетки человека в монослойном и сфероидном состоянии. Оказалось, что в 2D-системе выжило только 5% клеток, тогда как в 3D-среде живыми и здоровыми остались 75% [47]! Эффективность препарата в 3D-культуре была в 15 раз ниже, и если руководствоваться лишь данными на монослоях, можно уверовать, что было создано революционное лекарство от рака, которое на деле окажется просто пшиком...
Но и это еще не всё. Опухолевые клетки в организме выделяют сигнальные молекулы в среду и таким образом готовят специальные ниши для будущих метастазов: читайте об этом феномене в статье «Опухолевые разговоры, или Роль микроокружения в развитии рака» [48]. Поэтому лекарство обязано действовать не только на раковые клетки, но и на их микросреду. В монослойной культуре такого сделать просто нельзя. В результате тестирование противоопухолевых средств на 2D-моделях нередко приводит к ложно-успешным результатам (табл. 4). И, к сожалению, опухоли — не единственный пример, когда монослой так подводит исследователей.
| Показатель | 2D-модели | 3D-модели |
|---|---|---|
| Морфология | Вытянутые, плоские | Естественная форма в сфероидах |
| Пролиферация | Пролиферируют быстрее, чем in vivo | В зависимости от типа клеток могут пролиферировать либо быстрее, либо медленнее |
| Воздействие препарата и среды | Клетки одинаково подвержены | Не может проникать в центр сфероида |
| Стадия клеточного цикла | Одна | Разные |
| Экспрессия генов | Отличается от in vivo | Аналогична in vivo |
| Чувствительность к препарату | Чувствительны | Более устойчивы |
Всё сходится к тому, что 3D-культура клеток — гораздо более подходящая модель поведения и организации клеток in vivo. Но есть у нее, увы, и минусы по сравнению с хорошо зарекомендовавшим себя культивированием в монослое. Из-за своей новизны техника трехмерного культивирования еще не отлажена и сложна в обращении. Наконец, она просто дорогá [45].
Мышь или пробирка? Что перевесит на чаше весов доКИ?
Безусловно, основной моделью в доКИ остаются животные. С помощью экспериментов in vivo пока наиболее точно удается воссоздать процессы, происходящие при попадании новых лекарств в организм человека, а потому без них не обойтись.
Однако в последние десятилетия мы наблюдаем бум применения 3D-культур в тестировании терапевтических средств. С их появлением клеточные технологии становятся всё более популярными, поскольку растет релевантность получаемых с их помощью результатов. В ближайшем будущем прогрессивные модели in vitro продолжат вытеснять животных, занимая в доКИ всё более значимое место. В следующей статье спецпроекта мы поговорим об одной такой технологии, затронутой в этом материале лишь по касательной, — об органах-на-чипе.
Литература
- Победитель бактерий;
- Бессмертные клетки Генриетты Лакс;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: клеточные технологии;
- 12 методов в картинках: проточная цитофлуориметрия;
- Была клетка простая, стала стволовая;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- In vivo — in vitro — in silico;
- 12 методов в картинках: «сухая» биология;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- С миру по нитке: как соединились компоненты клинического исследования;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Поиск лекарственных мишеней;
- Виртуальные тропы реальных лекарств;
- Три поколения лекарств;
- Petra Simon, Tana A. Omokoko, Andrea Breitkreuz, Lisa Hebich, Sebastian Kreiter, et. al.. (2014). Functional TCR Retrieval from Single Antigen-Specific Human T Cells Reveals Multiple Novel Epitopes. Cancer Immunol Res. 2, 1230-1244;
- Клетки, которые лечат людей;
- Что такое внеклеточный матрикс и почему его все изучают;
- Abhisek Mitra, Lopa Mishra, Shulin Li. (2013). Technologies for deriving primary tumor cells for use in personalized cancer therapy. Trends in Biotechnology. 31, 347-354;
- Апоптоз, или Путь самурая;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Живые магниты: применение бактериальных магнетосом;
- Теломеры и новые мишени протоонкогенной терапии;
- Наработка антител для доклинических и клинических испытаний;
- Полиомиелит: убийца из XX века;
- Emine Cifcibasi Yek, Serdar Cintan, Nursen Topcuoglu, Guven Kulekci, Halim İssever, Alpdogan Kantarci. (2010). Efficacy of Amoxicillin and Metronidazole Combination for the Management of Generalized Aggressive Periodontitis. Journal of Periodontology. 81, 964-974;
- Seung Ho Lee, Min Ji Sung, Hyang Mi Lee, Daehyun Chu, Sang June Hahn, et. al.. (2014). Blockade of HERG Human K+ Channels by the Antidepressant Drug Paroxetine. Biol. Pharm. Bull.. 37, 1495-1504;
- André Guillouzo, Anne Corlu, Caroline Aninat, Denise Glaise, Fabrice Morel, Christiane Guguen-Guillouzo. (2007). The human hepatoma HepaRG cells: A highly differentiated model for studies of liver metabolism and toxicity of xenobiotics. Chemico-Biological Interactions. 168, 66-73;
- Rozenn Jossé, Caroline Aninat, Denise Glaise, Julie Dumont, Valérie Fessard, et. al.. (2008). Long-Term Functional Stability of Human HepaRG Hepatocytes and Use for Chronic Toxicity and Genotoxicity Studies. Drug Metab Dispos. 36, 1111-1118;
- R. Shrivastava, C. Delomenie, A. Chevalier, G. John, B. Ekwall, et. al.. (1992). Comparison of in vivo acute lethal potency and in vitro cytotoxicity of 48 chemicals. Cell Biol Toxicol. 8;
- Ты не пройдешь: в поисках идеальной системы для доклинического тестирования противоопухолевых препаратов;
- Mark W. Tibbitt, Kristi S. Anseth. (2009). Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol. Bioeng.. 103, 655-663;
- Ahmed A. Al-Sayed, Remigius U. Agu, Emad Massoud. (2017). Models for the study of nasal and sinus physiology in health and disease: A review of the literature. Laryngoscope Investigative Otolaryngology. 2, 398-409;
- Vladimir Mironov, Richard P. Visconti, Vladimir Kasyanov, Gabor Forgacs, Christopher J. Drake, Roger R. Markwald. (2009). Organ printing: Tissue spheroids as building blocks. Biomaterials. 30, 2164-2174;
- Тумороиды — микроопухоли в пробирке;
- Wei Liao, Jieqing Wang, Jiecheng Xu, Fuyu You, Mingxin Pan, et. al.. (2019). High-throughput three-dimensional spheroid tumor model using a novel stamp-like tool. J Tissue Eng. 10, 204173141988918;
- Человек на чипе;
- David Bovard, Antonin Sandoz, Karsta Luettich, Stefan Frentzel, Anita Iskandar, et. al.. (2018). A lung/liver-on-a-chip platform for acute and chronic toxicity studies. Lab Chip. 18, 3814-3829;
- Qirui Wu, Jinfeng Liu, Xiaohong Wang, Lingyan Feng, Jinbo Wu, et. al.. (2020). Organ-on-a-chip: recent breakthroughs and future prospects. BioMed Eng OnLine. 19;
- I-Chi Lee. (2019). Cancer-on-a-chip for Drug Screening. CPD. 24, 5407-5418;
- От медицины для всех — к медицине для каждого!;
- Фармакогеномика: изучение генов на службе персонализированной медицины;
- Органы из лаборатории;
- Chao Ma, Yansong Peng, Hongtong Li, Weiqiang Chen. (2021). Organ-on-a-Chip: A New Paradigm for Drug Development. Trends in Pharmacological Sciences. 42, 119-133;
- Eddy-Tim Verjans, Jordi Doijen, Walter Luyten, Bart Landuyt, Liliane Schoofs. (2018). Three-dimensional cell culture models for anticancer drug screening: Worth the effort?. J Cell Physiol. 233, 2993-3003;
- Odilia Osakwe. (2016). Preclinical In Vitro Studies: Development and Applicability. Social Aspects of Drug Discovery, Development and Commercialization. 129-148;
- Karol Jaroch, Alina Jaroch, Barbara Bojko. (2018). Cell cultures in drug discovery and development: The need of reliable in vitro-in vivo extrapolation for pharmacodynamics and pharmacokinetics assessment. Journal of Pharmaceutical and Biomedical Analysis. 147, 297-312;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Daniela Loessner, Kathryn S. Stok, Matthias P. Lutolf, Dietmar W. Hutmacher, Judith A. Clements, Simone C. Rizzi. (2010). Bioengineered 3D platform to explore cell–ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31, 8494-8506;
- Jungwoo Lee, Meghan J. Cuddihy, Nicholas A. Kotov. (2008). Three-Dimensional Cell Culture Matrices: State of the Art. Tissue Engineering Part B: Reviews. 14, 61-86;
- Shoaib Majeed, Stefan Frentzel, Sandra Wagner, Diana Kuehn, Patrice Leroy, et. al.. (2014). Characterization of the Vitrocell® 24/48 in vitroaerosol exposure system using mainstream cigarette smoke. Chemistry Central Journal. 8;
- David Bovard, Albert Giralt, Keyur Trivedi, Laurent Neau, Petros Kanellos, et. al.. (2020). Comparison of the basic morphology and function of 3D lung epithelial cultures derived from several donors. Current Research in Toxicology. 1, 56-69.