Сириус: четыре научных стихии
30 декабря 2022
Сириус: четыре научных стихии
- 1444
- 0
- 1
Четыре научных направления Университета «Сириус», освещенные в этой статье: »Биоматериалы», «Нейробиология», «Нанобиомедицина» и «Иммунобиология и биомедицина».
Рисунок в максимальном разрешении.
иллюстрация Лили Матвеевой
-
Авторы
-
Редакторы
-
Иллюстратор
Сириус стал одной из первых звезд, у которых обнаружили собственное движение. Университет «Сириус», несмотря на свой юный возраст, отличается от большинства российских вузов. Ждет ли его блестящая неповторимая история и свой звездный путь? Заключительная статья спецпроекта «Если звезды зажигают» познакомит нас с исследованиями четырех его научных направлений: «Биоматериалы», «Иммунобиология и биомедицина», «Нейробиология» и «Нанобиомедицина».
Если звезды зажигают

«Биомолекула» продолжает рассказывать о том, как и где можно получать биологическое образование и работать по научной специальности в России. В этом спецпроекте мы объединились с Университетом «Сириус», расположенным на одноименной федеральной территории на берегу Черного моря. За три публикации мы познакомим читателей с тем, какие исследования в нем ведутся, какие программы магистратуры и аспирантуры уже открыты и какие планы по развитию «Сириуса» есть у руководства университета. Чтобы разобраться во всех этих вопросах, авторы проекта пообщаются с российскими учеными, которые выбрали самый молодой вуз России местом своей работы.
Партнер спецпроекта — Университет «Сириус». Инновационный научно-технологический центр «Сириус» – это «город» внутри Сочи с собственными научно-технологическим университетом, инфраструктурой и с резидентами, «делающими» науку.
Перед вами третья — она же заключительная — статья спецпроекта «Биомолекулы» об одном из самых перспективных и молодых университетов России. Первая публикация уже рассказала читателям о том, как живет и работает Университет «Сириус» [1], а вторая позволила с головой окунуться в исследования Университета по направлениям «Биотехнология» и «Генная терапия» [2]. Так продолжим же погружение в тематики «Сириуса» и познакомимся с направлениями «Биоматериалы», «Иммунобиология и биомедицина», «Нейробиология» и «Нанобиомедицина».
Эти научные направления в структуре Университета представляют Научный центр генетики и наук о жизни. Исследования научных направлений, о которых пойдет речь в этой статье, несмотря на многообразие подходов, материалов и решаемых задач, ставят одну цель: улучшить, продлить, сделать более здоровой нашу жизнь. С позиции применения биосовместимых имплантатов смотрит на эту цель направление «Биоматериалы». Так ли далеки от нас разработки, позволяющие заменить поврежденный ткань или орган, «помочь» организму регенерировать и, выполнив свою функцию, бесследно исчезнуть? Мы поговорим, что по этому поводу может сказать мировая наука и, конечно же, исследования «Сириуса».
Наука о защите нашего организма широка и многогранна: сотрудники направления «Иммунология и биомедицина» занимаются не только фундаментальными иммунологическими исследованиями. В числе актуальных проектов направления значатся идентификация мутаций в генах, затрагивающих иммунологические функции защиты организма. Кроме того, методами обратной генетики исследователи создают новые мышиные модели различных заболеваний, а методами биоинженерии конструируют прототипы иммунотерапевтических препаратов. И, конечно же, «Иммунология и биомедицина» не могла обойти стороной изучение коронавирусной инфекции. Какая же вакцина дает наилучший профилактический эффект? Ученые-иммунологи «Сириуса» ищут ответ и на этот вопрос! Еще один проект направления в области COVID-19 сосредоточен вокруг поиска пептидов, способных заблокировать взаимодействие вирусного S-белка с человеческим ферментом ACE2, служащим коронавирусам рецептором.
Направление «Нейробиология» изучает одну из самых злободневных тем — стресс, его влияние на здоровье и, в частности, на развитие нейропсихических заболеваний. Нейробиологи «Сириуса» при этом используют подходы, которые можно встретить далеко не в каждом вузе России: в качестве модельных организмов выступают... рыбки данио!
Научное направление «Нанобиомедицина» связано с разработкой крошечных вводимых в организм устройств, которые должны выполнять настолько впечатляющую работу, что за ними, вероятно, будущее терапии многих заболеваний. Речь пойдет не о «чипировании», конечно, а о наночастицах. Создание таких устройств звучит как нечто из области фантастики, но уже существующие в этой области разработки, о которых писала и «Биомолекула» [3], вселяют надежду, что через несколько десятилетий медицина будущего станет реальностью. Ученые, занимающиеся нанобиомедициной в «Сириусе», исследуют возможности их применения как для таргетной доставки препаратов, так и для мониторинга показателей внутренней среды организма.
Биоматериалы: хороший имплантат — биорезорбируемый имплантат
Использование материалов, способных контактировать с тканями человеческого тела и даже выполнять их функцию, давно будоражит исследовательские умы. Насколько далеко наука продвинулась в этой области? Прежде чем погрузиться в исследования Университета «Сириус» по направлению «Биоматериалы», совершим небольшой исторический экскурс и сразу вернемся обратно, в мир современной науки.
Развитие человечества всегда шло рука об руку с применением различных материалов: стоит вспомнить хронологическую линейку из каменного, бронзового и железного века со школьных уроков истории. Мысленно вернемся на несколько тысячелетий назад, ко времени зарождения медицины. Удивительно, но имплантаты из различных материалов применялись уже 2000 лет назад — задолго до того, как стать трендом современной медицины. Изобретательные древние египтяне использовали кусающихся муравьев для наложения хирургических швов [4], а майя применяли ракушки в качестве зубных имплантатов [5].
Благодаря многовековой практике врачей, по крупицам собирались знания об изготовлении медицинских имплантатов, которые бы не причиняли вреда организму. Хирурги, например, всё чаще пытались использовать металлические винты и пластины для закрепления костей. Но большинство металлов не годилось для операций из-за окислительных процессов, которые происходили с ними в организме. Наконец, в 20-м веке развитие технологий позволило обратить внимание на титан. Обработка его поверхности позволила достичь структуры, которая не отторгается живыми тканями. Биоинертность титана и его способность к остеоинтеграции — сращению металла с костной тканью — привела к новой, наиболее прогрессивной на тот момент системе протезирования.
И сегодня титан широко применяется в качестве материала для медицинских имплантатов. Однако не всё так безоблачно в мире титановых протезов: основной проблемой остается возможная цитотоксическая реакция организма на биоинертный материал. С целью избежания подобных казусов на титановые имплантаты обычно наносят биосовместимые покрытия. Более того, нужно понимать, что титановый протез сам по себе никуда не исчезнет из организма.
«Эра полимеров» наступила в начале 20-го века, когда после нескольких лет напряженной работы американский химик Лео Бакеланд изобрел первый синтетический пластик — бакелит (рис. 1А, 1Б). Однако отцом современной полимерной науки по праву считается Герман Штаудингер (рис. 1В). Именно этот немецкий ученый и химик впервые описал строение макромолекул, которые сегодня мы называем полимерами. За свою работу в 1953 году он был удостоен Нобелевской премии. В науке произошел полимерный бум, началось производство полиэтилена, полиамида и других пластмасс, которые сегодня широко внедрились в нашу повседневную жизнь, в том числе и в медицину.
Сегодня чаще всего имплантаты применяют для введения в сердечно-сосудистую и костную системы, при изготовлении шовных материалов, в офтальмологии. Спектр применяемых при этом биоматериалов давно не ограничивается титаном и изобретением Бакеланда: это различные сплавы металлов, керамические и углеродные материалы, большое количество полимеров. Но для большинства из них характерны те же «титановые» проблемы.
Сейчас перед биомедициной стоит задача поиска альтернативных материалов, природоподобных и биоразлагаемых. Идея, разумеется, не нова: в мире уже изготавливаются подобные имплантаты с применением различных технологий [6]. В качестве биорезорбируемых материалов часто используют металлы (например, магний, который присутствует и в клетках нашего организма), биоразлагаемые синтетические полимеры (полилактид, полигликолид и др.). Такие биорезорбируемые материалы гидролизуются под воздействием среды самого организма. Время растворения при этом зависит как от материала и поверхности самого имплантата, так и от места внедрения в организм. Для того, чтобы имплантат беспрепятственно выполнял свою функцию, он должен быть биосовместимым. Также в набор свойств идеального биоматериала входит устойчивость к коррозии, которой способствует среда человеческого организма. По своим механическим свойствам биоматериал также должен быть похож на замещаемые им орган или ткань.
В России тоже активно работают над инновациями в этой области (о некоторых материалах для имплантов писала и «Биомолекула» [7]), включая и сотрудников направления «Биоматериалы». У них есть три основных проекта. Два из них связаны с разработкой медицинских изделий — уже известных нам костных крепежей с биоактивным покрытием, а также нанобиоматериалов нового поколения для восстановления кожного покрова. Еще один перспективный проект связан с созданием новых методов для доставки нуклеиновых кислот в клетку: имплантируемые устройства могут выполнять и функцию доставки лекарственных препаратов.
Если говорить о самих лабораториях направления «Биоматериалы», то, по словам руководителя направления «Биоматериалы» — Дмитрия Иванова, одного из ведущих российских специалистов в области создания новых функциональных материалов для солнечной энергетики, биомедицины и мембранных технологий, — оборудование позволит формировать из полимеров разные изделия (допустим, волокно или пленку), изучать физико-химические характеристики и структуры материалов. В лабораториях установлены и недавно были настроены и запущены электронные микроскопы, атомно-силовой микроскоп, уникальный дифрактометр для изучения структуры материалов, а также динамический механический анализатор — действительно впечатляющий список!
Исследователи «Сириуса», вдохновленные идеей создания биоразлагаемых полимеров, которые будут резорбироваться по мере восстановления тканей, занимаются разработкой отечественных медицинских изделий: например, биоразлагаемых винтов для сращивания костей. Как мы уже упоминали выше, сейчас при переломах ставят металлические — в основном, титановые — штифты. Пациенту приходится проходить через две операции и удалять штифты по мере сращения костной ткани. Биорезорбируемые медицинские изделия были бы элегантным решением этой проблемы: своеобразным «костылем», который утилизируется организмом по мере устранения проблемы.
Сотрудниками Университета только в 2020 году было выпущено три медицинских изделия, применяемых сейчас стоматологами и ортопедами. Более того, было проведено несколько десятков успешных операций с использованием мембраны для восстановления коленного сустава. Разработанная в университете умная мембрана, которая показала свою эффективность в регенерации поврежденных хрящевых тканей животных, проходит сейчас клинические испытания. Создаваемая университетская медицинская клиника в «Сириусе» и особый правовой режим федеральной территории только ускорит внедрение новых технологий в клиническую практику.
Наше направление фокусируется на создании синтетических биосовместимых материалов. Это значит, что клетки на их поверхности не будут погибать, а сами биоматериалы будут похожи на живые ткани нашего организма, например, будут обладать такими же механическими свойствами, как окружающая ткань. Это необходимо потому, что если имплантат сильно отличается от окружающих тканей, то они будут деформироваться. Значит, нужно сделать так, чтобы медицинское изделие по своим свойствам было один в один с окружающими тканями (то есть, чтобы искусственный материал был неотличим от них)
Уникальность разработки исследователей «Сириуса» в том, что они используют технологию электроспиннинга, позволяющего получить полимерные волокна диаметром несколько сотен нанометров (для сравнения, толщина волокон нашей одежды составляет около 10–15 мкм). Электроспиннинг, или электропрядение, позволяет изготавливать медицинские изделия, каркасы для биоинженерных тканей и органов , в том числе биодеградируемые. Пористость таких изделий позволяет обеспечить миграцию клеток в стенку протеза и формирование архитектуры ткани. Таким образом, структура скаффолда обеспечивает такие важные процессы, как адгезию, рост и пролиферацию клеток, а затем, по мере регенерации ткани, деградирует.
Кстати, у «Биомолекулы» можно почитать о тканевой инженерии поподробнее [8].
В «Сириусе» этот тканеподобный материал изготавливается из коллагена (рис. 2) [9]. Коллаген выполняет важные функции как во внутренних органах, так и в коже: благодаря этому белку наша кожа упругая, прочная и эластичная. Также коллаген отвечает за регенерацию тканей после повреждения. Однако с возрастом количество коллагена уменьшается; меняется и расположение волокон: именно поэтому кожа теряет свой «каркас» и становится дряблой. Пластыри и повязки на основе коллагеновых волокон будут обеспечивать хорошее прилегание и взаимодействие с клетками, быстрое восстановление ткани. В отличие от модифицированных металлических каркасов, электроспиннинговый каркас незаметен, а это безусловный плюс, например, в лицевой хирургии.

Рисунок 2. Сосудистые трансплантаты, изготовленные из коллагена с помощью технологии электропрядения: общий внешний вид устройства и сканирующая электронная микроскопия внутреннего и внешнего слоя.
Современная медицина стремится выполнить и другую задачу, имплантировав в организм пациентов электронные датчики. Поспешим успокоить: может быть, эра киборгов и ожидает нас в ближайшем будущем , но вживление крошечных электронных устройств необходимо исключительно в медицинских целях: для измерения жизненно важных показателей организма и мониторинга послеоперационного состояния. Непрерывный мониторинг температуры, давления, концентрации кислорода и глюкозы в режиме реального времени позволяет также вовремя подключить к работе медицинскую помощь в случае острой необходимости. «Сейчас развивается очень много проектов по созданию электроники и элементов, которые будут закрепляться на теле, в том числе в имплантах. Например, элементы питания: для маленького кардиостимулятора нужна маленькая батарейка, которая будет находится внутри организма. Все это сейчас находится на этапе бурного развития», — рассказывает Дмитрий Иванов.
Про носимые девайсы и другие инновационные технологии в медицине и в жизни можно прочитать также на «Биомолекуле»: «„Большой брат следит за тобой“, или Как развитие технологий меняет нашу жизнь» [10], «Киборги среди нас» [11], «Мобильные технологии для жизни и спорта» [12].
Графитовые материалы, включая графен, фуллерены и углеродные нанотрубки, перспективны для изготовления подобных крошечных устройств, и над ними, среди прочих, ведется работа в «Сириусе». Графит — слоистый материал: стоит вспомнить стержень карандаша, которым вы пишете. При этом слой за слоем графит легко отрывается и оказывается на бумаге. Если этот процесс продолжить, можно получить слой графита толщиной в один атом — это и называется графеном. Кстати, за открытие графена Андрей Гейм и Константин Новосёлов в 2010 году удостоились Нобелевской премии. «Это материал удивительный по своим свойствам: электропроводности, прочности, оптическим свойствам. В дальнейшем, я думаю, он будет использоваться в медицине как материал для электродов, имплантов», — подчеркивает Дмитрий Иванов.
Ученый также отмечает, что будущее стоит за созданием сложных и гибридных устройств, в которых присутствует как органическая, биорезорбируемая часть, так и система электронных датчиков. Она поможет вашему врачу получать информацию о параметрах и состоянии импланта непосредственно из вашего тела. «В этом ключе необходимо развитие электроники, которая была бы биосовместима и которую можно будет помещать не только на человеческое тело, но и внутрь него», — говорит Дмитрий Иванов.
Проблему с биосовместимостью ученые «Сириуса» совместно с коллегами из Федерального Научно-клинического Центра Физико-Химической медицины, а также Института Молекулярной Биологии им. Энгельгардта решили изящным образом. Дело в том, что механизмы защиты нашего организма воспринимают попавшие в него инородные тела как угрозу и стремятся их нейтрализовать или отторгнуть. Исследователями «Сириуса» недавно была выпущена статья, посвященная изучению графитового материала, поверхность которого «дополнена» пептидами и другими органическими молекулами, позволяющими избежать отторжения со стороны иммунной системы [13].
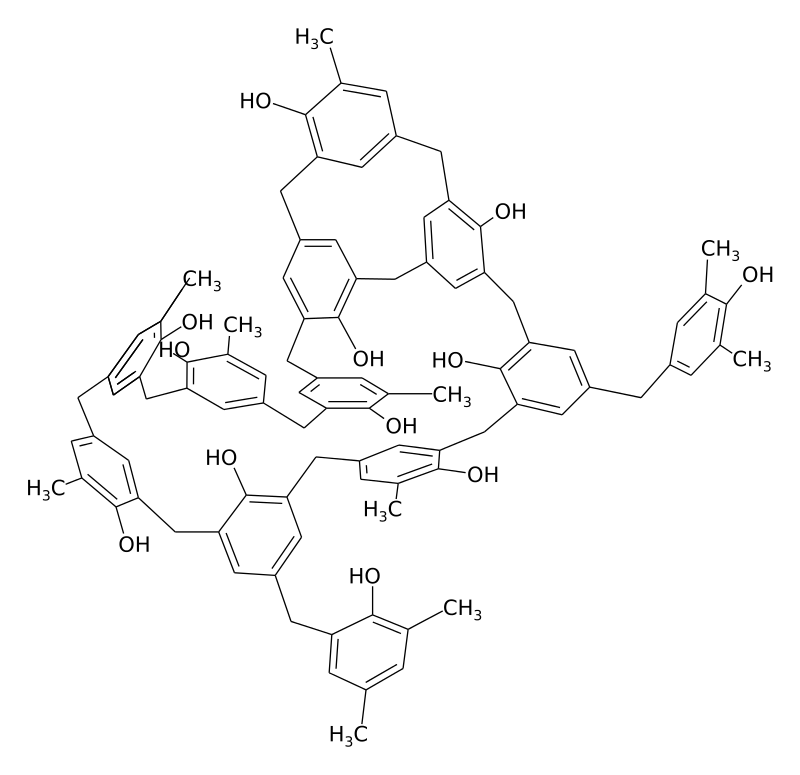
Известно, что различные органические молекулы умеют «собираться» в организованные структуры на различных поверхностях. Связи в углеводородных органических молекулах также способствуют этой самосборке, что не могло не привлечь внимание исследователей — ведь тогда графитовые материалы становятся потенциально полезными в качестве биоматериалов и интерфейсов для биосенсоров. Самособирающиеся пептиды на графитовых поверхностях необходимы для создания биосовместимых устройств. Лучше всего для модификации графитовой поверхности подходит молекула на основе олигоглицина и углеводорода (N,N’-(декан-1,10-диил)-бис-(тетраглицинамид), GM, рис. 3а). Белки, которые «прилипают» к графитовой поверхности, модифицированной этой молекулой, сохраняют свои размеры и конформацию. Более того, такая поверхность является привлекательным субстратом для роста клеток.
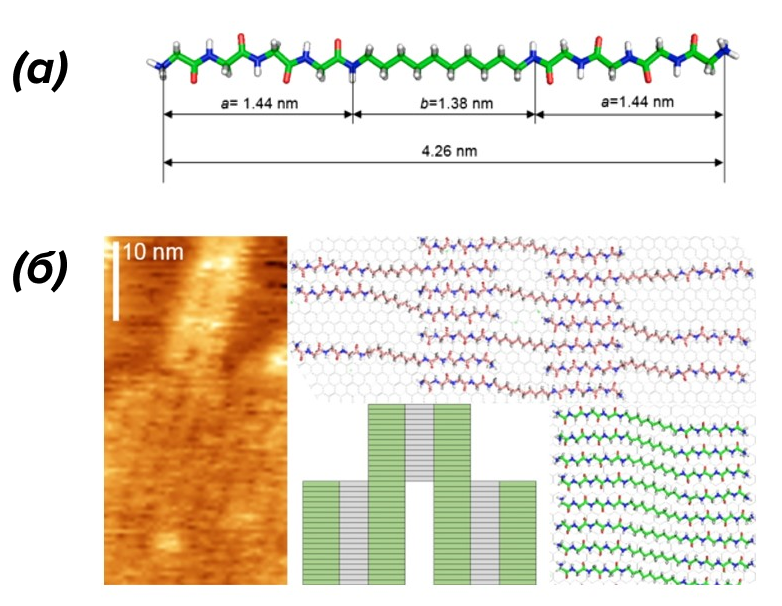
Рисунок 3. N,N’-(декан-1,10-диил)-бис-(тетраглицинамид), или GM.
(а) — молекулярная модель молекулы. Указаны полная длина молекулы и длины тетраглицидиламидной (а) и углеводородной (b) частей.
(б) — гипотетическая схема, иллюстрирующая упорядоченное расположение молекул GM на графитовой поверхности.
Однако как происходит адсорбция самих молекул GM на графитовой поверхности в течение долгого времени было неясно. С помощью атомно-силовой микроскопии исследователям из «Сириуса» совместно с коллегами удалось изучить этот процесс (рис. 3б). Если пропустить скитания по дебрям атомно-силовой микроскопии [14], можно сказать, что это исследование позволяет понять свойства модифицированных таким образом графитовых поверхностей, а значит, и применять их на деле.
Нетрудно догадаться, что исследования такого уровня требуют хорошо оборудованных лабораторий. Первое время сотрудники работали дистанционно, на площадках партнеров: МГУ и Института физико-химической медицины. Сейчас, по словам Дмитрия Иванова, в лабораторных помещениях уже всё готово, практически все приборы установлены и настроены. В ближайшие месяцы сотрудникам удастся полностью реализовывать свои проекты уже на территории «Сириуса».
Иммунология и биомедицина: снять корону!
В сегодняшнем путешествии в научный мир «Сириуса» мы познакомимся также и с исследованиями направления «Иммунология и биомедицина», возглавляемого Сергеем Недоспасовым — ученым, стоявшим у истоков кафедры иммунологии МГУ, первой в России из числа функционирующих на базе классических, а не медицинских университетов.
Сотрудники научного направления «Иммунобиология и биомедицина» и Ресурсного центра «Клеточные технологии и иммунология» проводят исследования иммунологических аспектов COVID-19. Кроме того, создается собственная коллекция иммунологических реагентов, которые должны помочь проводить в «Сириусе» исследования в условиях санкций. Наконец, в ожидании запуска вивария Университета «Сириус» в сотрудничестве с ИЦиГ СО РАН и ИБХ РАН разрабатывают новые мышиные модели для иммунологических исследований.
Снять корону
Тематика исследований в области SARS-CoV-2 неисчерпаема — сложно найти естественно-научную область знаний, которая бы так или иначе не коснулась этого направления. Конечно же, иммунологов в первую очередь заинтересовали вопросы вакцинации и механизмов, способных препятствовать проникновению вируса в клетки человека.
Мы решили заняться этой проблемой, как только нас стали выпускать из карантина в лаборатории. Ведь мы — единственная иммунологическая лаборатория в Университете «Сириус», а кругом сотни наших коллег, у которых были вопросы по вакцинации: многие переболели, немалое число людей не хотели вакцинироваться. Мы в этом исследовании видели свою миссию, даже понимая, что у нас не будет возможности набрать большие когорты. Но с точки зрения фундаментальной иммунологии, у шести вакцин, которые мы исследовали, реализовано четыре принципиально разных идеи доставки антигена. Поэтому мы и ожидали, что даже на небольших группах увидим разницу, и далее будем изучать этот вопрос более глубоко. Так и получилось. Ну, и с гордостью могу сказать, что наша деятельность помогла убедить добрую сотню людей в «Сириусе» и вокруг него вакцинироваться, а затем — ревакцинироваться
Цель была — сравнить эффективность различных вакцин, направленных на профилактику коронавирусной инфекции. Напомним, что вакцинация населения России началась в начале 2021 г. на фоне очень серьезной нагрузки на медицинские службы и учреждения. Первой зарегистрированной российской вакциной стал Sputnik V, разработанный в Центре им. Гамалеи [15]. За ней последовала пептидная вакцина ЭпиВакКорона Центра «Вектор» [16] и полновирионная инактивированная вакцина Центра им. М.П. Чумакова — КовиВак. В то же время, в странах Европейского союза и Северной Америки широкое распространение получили вакцины на основе мРНК-платформы.
Вакцина вакцине рознь
Ученые «Сириуса» поставили перед собой цель сравнить эффективность нескольких известных вакцин (трех отечественных и трех зарубежных) по способности вызывать антительный иммунный ответ на несколько вирусных эпитопов — частей молекулы антигена, которые распознаются иммунной системой с последующим определением уровня нейтрализующих антител. Для этого у части участников исследования был определен Т-клеточный ответ на конкретные эпитопы вирусных белков. Кроме того, удалось сравнить гуморальный ответ после нескольких схем ревакцинации. Так как одним из свойств S-белка, точнее, его рецептор-связывающего домена (RBD), является способность сливать оболочку вируса с клеткой человека, было решено анализировать уровень антител именно к этому домену. Sputnik V, равно как и мРНК-вакцины, вызывали сильный антительный ответ, не отличающийся по титрам от ответа у переболевших. Однако через 6 месяцев уровень ответа для всех исследованных вакцин значительно снижался (рис. 5а, 5б) [18].
Важным этапом развития работ по изучению иммунного ответа на вакцинации стало внедрение псевдовирусной системы для определения способности сывороточных антител блокировать вход вируса в клетку, несущую на поверхности молекулы АСЕ2 — рецепторы вируса SARS-CoV-2 (эту технологию «Сириусу» помогли наладить сотрудники Института Биологии Гена РАН). Возможность встраивать в искусственный капсид рекомбинантные варианты S-белка из любого штамма позволяет ученым получать псевдовирусные частицы — своеобразные химеры, полностью имитирующие молекулярные особенности поверхности натурального вируса. Прелесть работы с такими частицами состоит в том, что они не способны к репликации, что делает работу ученых гораздо более безопасной, нежели манипуляции с настоящим вирусом. Лейтмотив этой системы заключается в возможности быстрой наработки и смены покрытия таких частиц разными типами S-белка от новых вариантов вируса SARS-CoV-2. В настоящее время с помощью этой технологии в Университете «Сириус» возможна оценка нейтрализующей способности антител как против изначального Уханьского варианта вируса, так и против вариантов Дельта и Омикрон. Использование такой технологии позволяет оценить защитную эффективность поствакцинального и постинфекционного иммунитета против различных вариантов вируса.
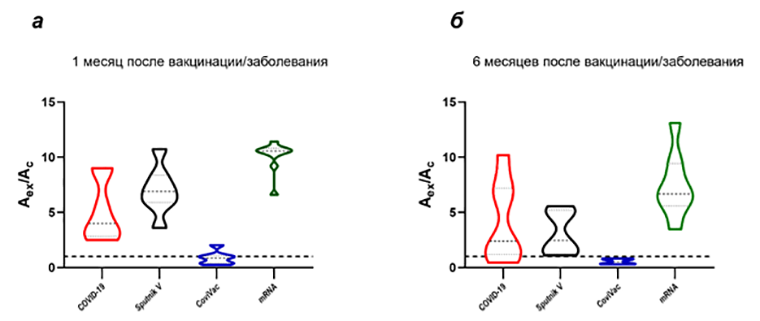
Рисунок 5. Уровень антител к RBD S-белка через месяц (а) и через полгода (б) после полного курса вакцинации или инфекции SARS-CoV-2. По оси Y — отношение оптической плотности образца к оптической плотности критического значения. mRNA — группа участников, вакцинированных вакцинами BNT162b2 (Pfizer/BioNTech) и mRNA-1273 (Moderna).
Исследование показало, что эффективность вакцин с появлением новых вариантов вируса снижается, что заставляет ученых включаться с инфекцией в «гонку вооружений». Более того, иммунитет, сформированный после перенесенной инфекции, может с меньшей эффективностью нейтрализовать как варианты, которые циркулировали ранее, так и варианты, которые могут появиться в будущем. Далее сотрудники Направления приступили к анализу эффектов различных схем ревакцинации. На рисунке 6а приведены данные по ревакцинации переболевших двумя отечественными вакцинами. Эффективный иммунный ответ восстанавливался и при ревакцинации ранее вакцинированных групп (рисунок 6б), при этом уровень антител через месяц после ревакцинации был существенно выше, чем до нее.
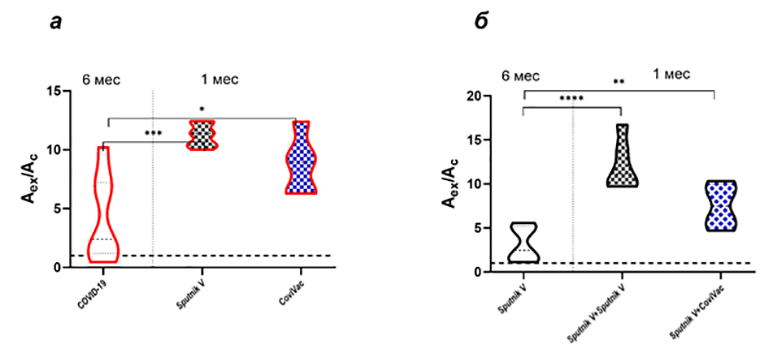
Рисунок 6. Уровни антител к RBD S-белка SARS-CoV-2 после вакцинации ранее переболевших (а) и ревакцинации не болевших COVID-19 (б). Показаны уровни антител через 6 месяцев после заражения или первичной вакцинации (6 мес) и через 1 месяц после вакцинации переболевших или ревакцинации не болевших COVID-19 (1 мес).
Наряду с антительным ответом, у избранных групп добровольцев анализировали и Т-клеточный ответ с использованием проточной цитометрии и технологии Elispot. Оказалось, что через полгода после инфекции SARS-CoV-2, а также после вакцинации как векторной (Sputnik V), так и полновирионной (CoviVac) вакцинами, у части добровольцев сохраняется специфический Т-клеточный иммунитет.
Цитометрический анализ позволил определить, какие популяции Т-клеток активируются при инфекции и вакцинации. У всех исследованных групп обнаруживались в основном специфические CD8+ клетки — цитотоксические Т-лимфоциты, играющие важную роль в иммунной защите от внутриклеточных патогенов. Именно эти лимфоциты реализуют специфические реакции иммунитета и тем самым разрушают пораженные вирусной инфекцией клетки. Важно отметить, что у испытуемых через месяц после ревакцинации существенно повышалась доля как CD4+, так и CD8+ S-специфических Т-клеток.
Как говорит Сергей Недоспасов «Биомолекуле», проект по вакцинам против COVID-19 будет продолжаться: «Собственных вакцин мы разрабатывать не планируем, так как это работа совершенно другого масштаба. Но какие-то новые идеи в ходе исследований могут возникнуть — на то это и наука. Если не сможем реализовать сами, передадим другим. „Сириус“ как раз нацелен на подобную кооперацию».
Нейробиология: спокойствие, только спокойствие!
Патологии и травмы нервной системы — одна из центральных проблем здравоохранения во всем мире. По данным ВОЗ, количество лиц, страдающих болезнью Паркинсона, превысило 8,5 млн человек, и эта цифра постоянно растет. Болезнь Альцгеймера вошла в десятку самых распространенных причин смертности, а инсульт в ней расположен аж на втором месте. Ежегодно в мире от 250 000 до 500 000 человек получают травмы спинного мозга или страдают от болезней, затрагивающих этот жизненно важный орган. Помимо этого, пациентам с подобными патологиями необходима серьезная медицинская помощь, часто — ежедневный уход, что обходится здравоохранению в десятки миллионов долларов ежегодно.
На базе Научного центра генетики и наук о жизни функционирует направление «Нейробиология». Исследователи-нейробиологи «Сириуса» изучают множество областей этой науки: от механизмов возникновения и развития патологий центральной нервной системы (ЦНС) и стресса до применения искусственного интеллекта для профилирования лекарств и нейропротезирования. Но обо всем по порядку.
Недавно руководителем этого направления стал доктор медицинских наук Павел Мусиенко. Помимо должности в «Сириусе», Павел руководит лабораторией нейропротезов Института трансляционной биомедицины СПбГУ. За годы научной деятельности ученый публиковался и стал соавтором статей в крупнейших научных журналах, среди которых Science [22], Nature Medicine [23], Lancet [24], Nature Neuroscience [25]. В списке тем, над которыми трудится ученый, можно найти патофизиологию повреждений спинного мозга, нейропротезирование функций ЦНС при заболеваниях и травмах, экспериментальную нейрореабилитацию, спинальные и стволовые нейрональные механизмы регуляции позы и локомоции.
Шаг влево, шаг вправо: интернейрон
Весной 2022 в авторитетном нейробиологическом журнале Journal of Neuroscience вышла статья, первым автором которой стал руководитель нейробиологического направления Университета «Сириус» [26]. Исследование посвящено роли спинальных интернейронов в навигационном контроле во время активного передвижения и отражает деятельность первого направления исследований университета в области трансляционной нейробиологии, о котором мы расскажем.
В статье представлены данные о популяциях нейронных клеток спинного мозга, контролирующих направление при ходьбе. В отличие от ходьбы вперед, которая у высших позвоночных хорошо изучена, с передвижениями назад и вбок дела обстоят иначе. До недавнего времени о локомоторных сетях в спинном мозге, отвечающих за них, не было известно. Для того, чтобы изучить, какие интернейроны ответственны за эти движения, ученые исследовали активность одних и тех же спинальных нейронов при ходьбе вперед и назад. Это позволило им выделить три группы нейронов. Нейроны 1-й группы, по-видимому, работают одинаково при передвижении в любом направлении и отвечают за подъем и опускание конечности. Нейроны же 2-й и 3-й групп не так просты и отвечают за направление шагания. Они составляют своеобразный «навигатор» в спинном мозге: нейроны 2-й группы меняют свою работу при изменении направления шага, а 3-й — и вовсе работают только во время движения в определенном направлении.
Один из методов этого исследования — эпидуральная стимуляция спинного мозга. Стимуляция поясничного отдела вызывала шагание в любом направлении относительно оси тела. Эта методика, однако, используется не только в экспериментах, но и широко распространена в клинической практике. Она основана на электрической стимуляции спинного мозга и позволяет снизить болевые ощущения, например, при травмах. Дело в том, что электрические импульсы активируют тормозящие боль нейроны в том месте, где в спинной мозг входят нервные окончания больного органа. Это позволяет «отключить» болевой импульс и нарушить его «переадресацию» в головной мозг. Достигается это следующим образом: пациенту в позвоночник вводится специальный тонкий электрод, который затем присоединяется к генератору, имплантируемому прямо под кожу. Ток низкой частоты от генератора идет по электроду прямо в спинной мозг (эпидуральное пространство). По завершении операции задаются необходимые параметры стимуляции.
Проведенная исследователями «Сириуса» работа не только объясняет работу нашего «навигатора» в спинном мозге, но и открывает новые горизонты в использовании эпидуральной стимуляции спинного мозга. «С помощью эпидуральной стимуляции можно воздействовать на триггерные зоны спинного мозга, которые запускают ходьбу в разных направлениях: назад или вперед,» — поясняет Павел Мусиенко. Поняв механизм стимуляции и изучив «мишень» действия — те самые триггерные зоны [27], потенциально можно справиться с восстановлением двигательной функции и контроля равновесия при травмах и патологиях ЦНС.
Нервные клетки не восстанавливаются! Или?...
Работу следующего проекта направления «Нейробиология» лучше один раз показать и сделать это на примере еще одной публикации этого года, вышедшей в международном журнале Progress in Neuro-Psychopharmacology & Biological Psychiatry [28]. В статье представлены революционные данные об участии нейрорецепторов к следовым аминам в запуске нейрогенеза. Соавторами статьи стали Павел Мусиенко; Евгений Будыгин — бывший руководитель направления «Нейробиология» — и Рауль Гайнетдинов — руководитель проекта по нейрогенезу в «Сириусе».
Совместно с коллегами в «Сириусе», Рауль Гайнетдинов занимается изучением нейрогенеза взрослых. Развитие иммуногистохимии, конфокальной микроскопии, генной инженерии и других инструментов современной науки позволяет поспорить с утверждением о том, что нервные клетки не восстанавливаются . Однако у взрослых этот процесс, конечно, отличается от эмбрионального нейрогенеза. В опубликованной недавно работе изучалась роль рецепторов следовых аминов в нейрогенезе [28].
Кстати, «Биомолекула» уже развеивала миф о том, что нервные клетки не восстанавливаются: «Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить» [32].
Следовые амины [33] представляют собой «неполные» аминокислоты, а именно — с удаленной кислотной частью. В особенно больших количествах следовые амины содержатся в ферментированных продуктах: сыре, вине, копченостях. На протяжении долгого времени они считались просто остатками метаболизма аминокислот и не подозревались в прямой передаче сигналов при психических расстройствах.
Всё изменилось с открытием в 2001 году семейства связанных с G-белком рецепторов следовых аминов (TAAR) [34]. Это открытие ознаменовало появление на научной арене еще одной нейротрансмиттерной системы вдобавок к хорошо известным дофаминовой [35], норадреналиновой [36], серотониновой [37] и других. Рецепторы TAAR представляют интерес еще и потому, что могут быть мишенями для терапии психоневрологических расстройств [38].
Из имеющихся у человека шести подтипов этих рецепторов, TAAR1 находится в головном мозге [39], а остальные до недавних пор считались обонятельными рецепторами. Однако ранее проведенные исследования под руководством Рауля Гайнетдинова показали, что TAAR5 также присутствует в нескольких областях мозга [40]. У мышей с «выключенным» геном TAAR5 наблюдались изменения в эмоциональном поведении, снижение тревожности и поведение, подобное депрессии, а на нейрохимическом уровне рецепторы TAAR5 влияли на дофаминовую систему [41]. Неожиданным оказалось то, что у нокаутных мышей без TAAR5 значительно усилилось образование новых нейронов дофамина в зонах мозга, в которых обычно происходит так называемый взрослый нейрогенез. Именно в субвентрикулярной и субгранулярной зонах головного мозга образуется небольшое число новых нейронов во взрослом состоянии, и именно там этот процесс усиливается при нокауте TAAR5.
Также внимание исследователей привлек родственный рецептор TAAR2, которому исходно приписывали только обонятельную функцию, но литературные данные последних лет заставляют задуматься о расширении этого спектра [39], [42–44]. В нескольких исследованиях его экспрессия обнаружилась в лейкоцитах, желудочно-кишечной системе, сердце, легких и, по некоторым данным, в головном мозге.
Чтобы приблизиться к разгадке настоящей функции TAAR2, исследователи также создали нокаутных мышей — на этот раз без рецептора TAAR2. Кроме этого, экспрессию TAAR2 ученые картировали по окрашиванию бета-галактозидазой (рис. 8). Дело в том, что мыши с нокаутом TAAR2 были получены путем рекомбинации гена, кодирующего TAAR2 с вектором, в котором содержалась последовательность, кодирующая бета-галактозидазу. Как и ожидалось, рецепторы TAAR2 нашлись в обонятельной луковице, но не только там! Они также были обнаружены в нескольких областях головного мозга, включая гиппокамп, мозжечок, кору, гипоталамус.
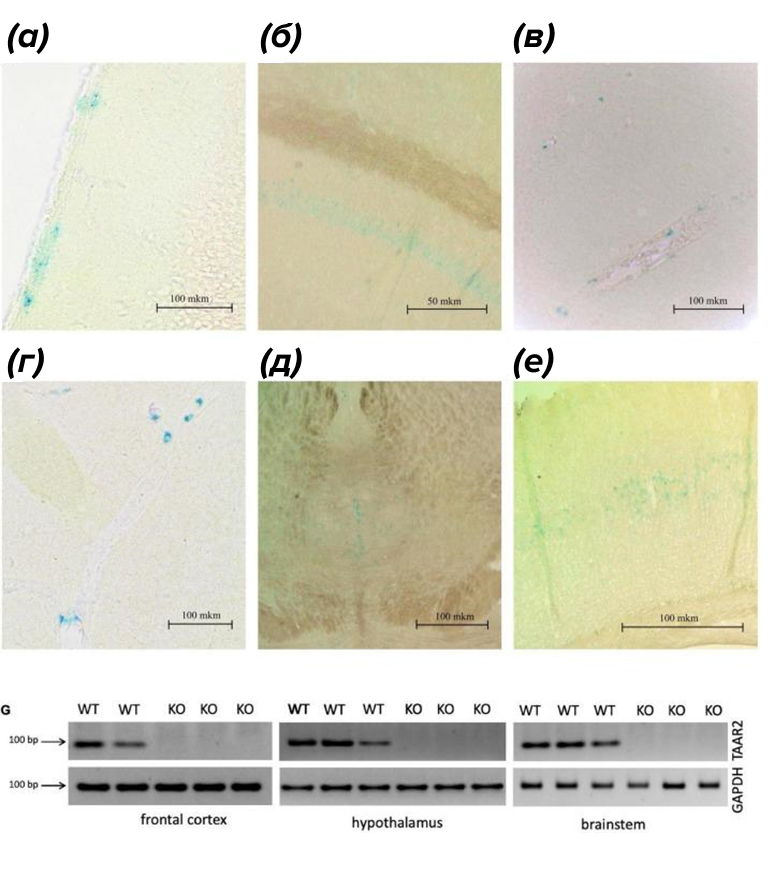
Рисунок 8. Экспрессия TAAR2 в коре головного мозга мыши. Окрашивание бета-галактозидазой показывает экспрессию TAAR2 в коре головного мозга мыши (а), гиппокампе (слой CA1) (б), гипоталамусе (в), латеральном поводке (г), ядрах шва (д), соматосенсорной коре, слое 5 (е).
Если говорить про поведенческие реакции, мыши с нокаутом TAAR2 показали усиление двигательной активности. У них также были повышены уровни дофамина в тканях полосатого тела и увеличено количество дофаминергических нейронов в черной субстанции, а в нейрогенных зонах мозга у мышей клетки пролиферировали более активно. Полученные данные говорят, во-первых, об участии TAAR2 в регуляции дофаминовой системы мозга и, во-вторых, о нейрогенезе у взрослых.
Возможно, рецепторы следовых аминов являются той системой, которая запускает процесс возникновения новых нейронов при разнообразных патологиях мозга. Если говорить о практическом применении данных исследований и перспективах, то из-за своего влияния на «взрослый» нейрогенез рецепторы TAAR открывают новые возможности для лечения нейродегенеративных заболеваний мозга, в том числе болезней Паркинсона и Альцгеймера.
В трансляционной нейробиологии — как рыба в воде
Трансляционная нейробиология требует получения надежных нейроповеденческих данных и мощных алгоритмов их обработки. Нейробиологи «Сириуса» не обошли стороной и эту грань исследований, поставив себе на службу искусственный интеллект (ИИ) . Его алгоритмы помогают исследователям справиться с большими объемами данных или сложностью их интерпретации, даже если работать надо с поведенческой моделью. Например, с помощью системы автоматического распознавания лиц искусственный интеллект может определить гнев человека [45] и даже выявить нейродегенеративное заболевание на ранних стадиях по едва заметным для человеческого глаза двигательным отклонениям [46], как отмечает еще один ведущий ученый-нейробиолог «Сириуса», доктор биологических наук, профессор РАН Алан Калуев. Широко используется ИИ и для анализа поведенческих реакций у различных экспериментальных животных, от дрозофил до приматов.
Как работает искусственный интеллект? Что такое нейронные сети? Стоит ли играть с роботом в шахматы? Об этом «Биомолекула» рассказывает в статье «От живого мозга к искусственному интеллекту» [47].
2022 год порадовал публикацией исследования на эту тему в журнале Progress in Neuro-Psychopharmacology & Biological Psychiatry, которое было проведено совместно с учеными «Сириуса» под руководством профессора Калуева [48]. Тут впервые совместили метод нейрофенотипирования (регистрации поведения) при воздействии новых фармакологических препаратов на рыбок зебраданио (zebrafish) и ИИ для предсказания, что получится.
Что? Рыбки? Да! Зебраданио — важный модельный организм для изучения нормального и патологического поведения, моделирования заболеваний ЦНС, скрининга лекарственных препаратов, в том числе нейроактивных (см. врезку). Воздействуя разными веществами на рыбок, ученые фиксировали их локомоторные треки, то есть траекторию передвижения по аквариуму. На основе серии таких треков ИИ научили распознавать психотропные вещества с различными действиями на ЦНС, а затем, используя алгоритмы машинного обучения, предсказывать поведение рыбок путем сравнения локомоторных треков для двух выбранных агентов с известными схожими поведенческими и фармакологическими профилями. Это исследование может быть положено в основу развития нейрофенотипирования с помощью ИИ в этом важном модельном организме.
В целом, перспективы применения зебраданио в трансляционной нейробиологии обнадеживают. Неудивительно, что уже сейчас зебраданио находятся на втором месте по числу используемых животных в биомедицинских экспериментах, уступая только лабораторным мышам. Благодаря своему быстрому развитию, удобству содержания и малым размерам, эти рыбы позволяют проводить массовый отбор препаратов, что снижает время разработки новых лекарств для пациентов. Сегодня вполне можно сказать, что зебраданио является новым модельным объектом в нейробиологии, который смогли по достоинству оценить ученые «Сириуса» и который обещает прорывы в лечении и выздоровлении пациентов со многими болезнями мозга.
Воздействие стресса и фармакологических соединений
Одна из проблем, над решением которой трудятся нейробиологи «Сириуса» — откуда берутся такие болезни, как депрессия, биполярное расстройство, шизофрения, посттравматические, стрессовые и другие нейропсихические расстройства. Стресс, уровень которого постоянно растет в современных реалиях, — один из главных факторов развития данных заболеваний. Вдумайтесь в эти цифры: если учитывать только тяжелые формы депрессии, согласно статистике, то ими страдают 3–7% населения (в зависимости от страны), а это порядка 350 млн человек. А сколько находятся вне поля зрения врачей?
Сотрудниками университета группы профессора Калуева совместно с зарубежными коллегами было проведено исследование, выявляющее влияние эстрадиола на ЦНС и поведение рыбок [52]. Этот гормон повышает исследовательскую активность рыбок, делает их более «социальными» и увеличивает размер стаи. Если учесть, что похожий эффект этот гормон оказывает и на грызунов, и на человека, то при изучении рыб можно прийти к пониманию сложных расстройств социального поведения. Всем известный парацетамол также не избежал исследования на рыбках данио: в целом, у подопытных препарат снизил интенсивность беспокойства [53].
Анксиотропные препараты — группа препаратов, влияющих на тревогу как у человека, так и у животных. В психофармакологии анксиотропные агенты включают две категории психоактивных препаратов: анксиолитики, которые уменьшают тревожность, и анксиогенные соединения, которые увеличивают беспокойство. Ученые «Сириуса» изучили действие веществ, относящихся к группе анксиотропных агентов: налоксона, аспирина и никотина [54].
Исследователи воздействовали на рыбок определенной концентрацией анксиотропных веществ, а затем регистрировали их траекторию и характер движений. Подопытные предпочитали плавать у дна аквариума, временами проявляя гиперактивность. Этот эффект заметно отличается от реакции млекопитающих на аналогичные анксиотропные вещества. Такая «нетрадиционная фармакология» обеспечивает новое понимание механизмов стресса и мишеней, на которые при этом можно подействовать лекарственными средствами (рис. 10).
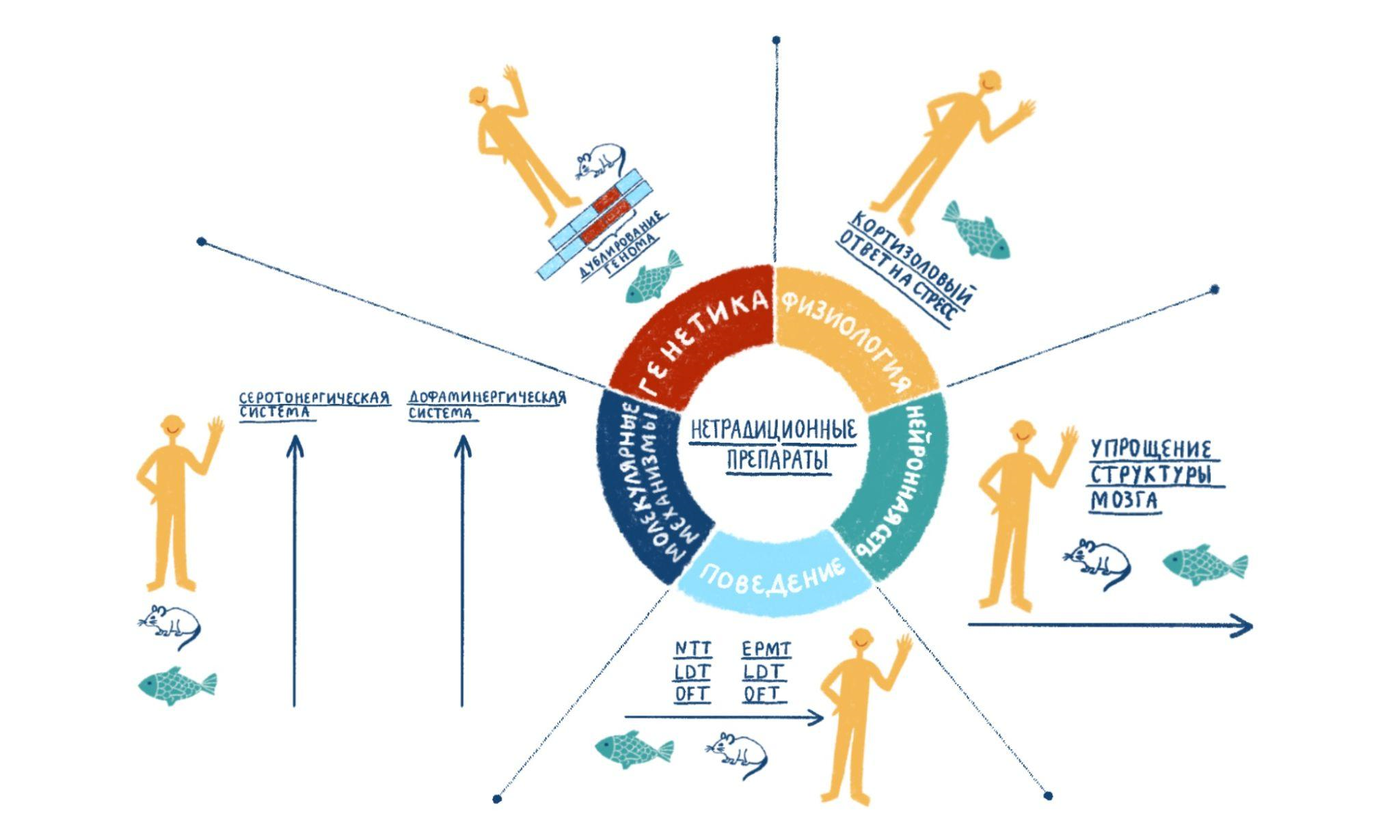
Рисунок 10. Изучение стресса с помощью анксиотропных препаратов. С генетической точки зрения, зебраданио обладают важной особенностью: дупликацией генома. С физиологической точки зрения, в ответе на стресс у рыбок данио, как и у людей, но в отличие от грызунов, участвует кортизол. Кроме того, рыбки данио обладают менее сложной структурой мозга, чем млекопитающие (например, у них отсутствует неокортекс). Поведенческие аспекты анализа учитывают тот факт, что животные модели имеют ограничения в оценке сложности тревоги у человека. Молекулярные аспекты основаны на некоторых различиях в нейрохимических системах у рыб и млекопитающих.
иллюстрация Лили Матвеевой по [54]
Интересные результаты показало также другое недавно опубликованное исследование ученых «Сириуса» из лаборатории профессора Калуева по выявлению половых отличий в реакции рыбок данио на скополамин — препарат антихолинергического действия. В первую очередь, исследователи провели поведенческие тесты и зафиксировали исходный уровень тревоги у самцов и самок зебраданио. Затем, после воздействия на рыбок скополамином и проведения повторных тестов, ученые выяснили, что у самок уровень тревоги заметно снижался, а самцы, напротив, «тревожились» все больше, тем самым напоминая половые различия в ответ на данные психотропные препараты в клинике.
Нейропротезирование
Восстановление функции поврежденных нейронов «силой мысли» — примерно так можно описать еще одно направление деятельности нейробиологов «Сириуса», ведь речь идет о нейропротезировании . Точкой отсчета истории нейропротезов можно считать изобретение кохлеарного имплантата — устройства, воздействующего непосредственно на слуховой нерв и позволяющего компенсировать потерю слуха. С развитием технологий появился и нейрокомпьютерный интерфейс (НКИ). Он позволяет пациенту, прошедшему специальное обучение, использовать электрические сигналы активности мозга для взаимодействия с НКИ, который обнаруживает эти сигналы и передает их уже в электронное устройство, выполняющее действие. Изобретение НКИ помогает пациентам вернуть многие утраченные функции: снова говорить, снова использовать утраченные конечности.
«Биомолекула» рассказывала о том, что такое нейропротезирование, что за будущее его ждет и какие мифы с ним связаны, в своей статье «Что такое нейропротезирование? Это вредно?» [55].
Сейчас функции нейропротезов не ограничиваются заменой конечности: в целом, нейропротез должен восстанавливать функцию нейронов. В клинической практике уже были успешно применены несколько типов нейропротезов, включая протезы для сетчатки или восстановления слуховых функций, обезболивания, сенсомоторной активности, произвольного контроля движений [29], [56], [57]. Однако в области нейропротезирования всё еще остается ряд серьезных проблем. Например, перед исследователями стоит вопрос разработки электродов с оптимальными механическими, электрическими и биологическими свойствами. В качестве потенциальных материалов тестировались многие полимеры и композиты: растяжимые эластомеры (полидиметилсилоксан ПДМС, термопластичный полиуретан ТПУ), электропроводные материалы (металлы, графен, углеродные нанотрубки), а также их различные сочетания.
Перед нейробиологами «Сириуса» встала задача использовать для изготовления электродов углеродные материалы, показавшие эффективность в стимуляции нейронов, но при этом сделать их достаточно маленькими, гибкими и, самое важное, биосовместимыми. Так, исследователи разработали технологию производства мягких нейронных имплантатов на основе углеродных нанотрубок и ПДМС [58]. При этом ПДМС используется в качестве тонкой полимерной подложки, на которую наносится проводящий материал. А углеродные наноматериалы показали многообещающий результат в стимуляции нейронов и позволяют избежать проблем, связанных с металлическими проводниками.
Проведенные тестирования полученного материала на растяжимость и цитотоксичность, а также циклическая вольтамперометрия выявили его отличные механические свойства, биостабильность и биосовместимость в организме, высокие значения емкости накопления заряда. Кроме того, функциональные возможности изготовленных имплантатов были изучены с помощью испытаний in vivo на лабораторных животных и показали достойную эффективность в мониторинге и стимуляции активности нейронов у млекопитающих.
Как мы видим, исследования направления «Нейробиология» в «Сириусе» охватывают разные области этой науки и ведутся на достойном уровне. Мы рассказали лишь о последних исследованиях, выполненных совместно с учеными университета и опубликованных в крупнейших научных журналах, которые показывают разные грани их работы в области трансляционной нейробиологии. А пока мы ждем новых результатов исследований «Сириуса» по направлению «Нейробиология», «Биомолекула» призывает сохранять спокойствие и не подвергать себя лишнему стрессу!
Нанобиомедицина: большое будущее «крошечной» медицины
Ну и напоследок мы расскажем о направлении «Нанобиомедицина», также входящем в Центр генетики и наук о жизни.
Современная медицина ежедневно сталкивается с необходимостью внедрения сложных и «умных» систем диагностики заболеваний. Несколько волн пандемии наглядно продемонстрировали человечеству, как быстро патогены способны мутировать и адаптироваться, а статистика онкологических заболеваний с каждым годом всё менее утешительна.
За приставкой «нано-» скрывается мощный потенциал развития технологий и медицины. Мир нанотехнологий предлагает различные наноматериалы, электронику, новые приборы и методы исследований; обещает развитие методов диагностики и лечения в наномедицине. Как далеки мы от нано-будущего сейчас? И что несут в себе нанотехнологии, помимо фантастических возможностей?
Сотрудники направления «Нанобиомедицина» занимаются созданием биоматериалов нового поколения — нанобиоматериалов. В рамках проекта предполагается создание «умной» конструкции, которая на основании анализа микроокружения сразу по нескольким параметрам сможет намного точнее ставить диагноз и прицельно воздействовать на источник заболевания. Звучит многообещающе — давайте разберемся, как это работает.
Ключом ко всему являются наночастицы, малый размер которых (1–100 нм) позволяет им двигаться как в сосудах, так и вне их. В более широком смысле к бионаноматериалам относятся нанотрубки, наноленты и нанопористые структуры. Всё это может стать платформой как для таргетной доставки препаратов , так и для мониторинга биологических показателей.
«Биомолекула» уже писала про адресную доставку препаратов, основанную на введении наночастиц, и про существующие препараты на их основе — «Наночастицы — инструмент адресной доставки лекарств» [60].
Так, для адресной доставки лекарств в медицине часто используются магнитные наночастицы, управлять которыми можно бесконтактно и с помощью внешнего магнитного поля «стягивать» в определенную область тела. Например, можно адресно доставить токсичное вещество прямо в очаг заболевания, не распыляя его при этом на другие органы. А «открыть» капсулу с препаратом можно, просто нагрев ее тем же магнитным полем.
Наночастицы можно покрыть биосовместимыми молекулами, декстраном или фосфолипидами, к которым «пришивают» антитела к специфическим антигенам. Такие наночастицы могут связываться с определенными клетками организма: эритроцитами, бактериями, раковыми клетками.
В медицинской практике наноматериалы используются также для ранней диагностики заболеваний. Для того, чтобы визуализировать ту или иную «подозрительную» структуру в организме, наночастицы дополняют флуоресцентной меткой. Тогда лиганды на поверхности наночастицы взаимодействуют с белками (специфическими, например, для раковой опухоли или холестериновых бляшек), а свечение в этой области проливает свет на расположение и структуру образования.
В медицине уже имеются успешные случаи использования нанобиоматериалов. Например, с помощью наносистем удалось выявить аневризмы аорты (истончения и выпячивания стенки сосуда) [61]. Золотые наночастицы используются в клинической медицине для экспресс-диагностики [62]; серебряные, из-за их антибактериального эффекта, — для создания перевязочных тканей и изготовления имплантатов. Магнитные наночастицы широко используются для отслеживания клеток in vivo, удаления из кровотока одиночных злокачественных клеток и клеточной сортировки. Стоит оговориться, что методы нанобиомедицины сравнительно недавно начали выходить из лабораторий, и большинству из них еще предстоит прилично дозреть.
Технологии, разрабатываемые в стенах «Сириуса», сфокусированы на сочетании в себе нескольких платформ одновременно, а также высокой достоверности идентификации и чувствительности к внешним факторам — маркерам заболеваний. Например, одни наночастицы в составе такой системы могут быть нагружены лекарственными веществами, другие — выполнять функцию адресной доставки, третьи — выполнять роль своеобразных датчиков, и т.д.
Руководит направлением «Нанобиомедицина» Максим Никитин, кандидат физико-математических наук, один из пионеров в области разработки «умных» наноматериалов на основе гибридных лиганд-зависимых наносистем, функционирующих на принципах молекулярного компьютинга.
Два в одном: совместная доставка лекарства и трансгена
Одно из важных направлений в области доставки лекарств — это генная терапия. Если говорить о генной терапии и доставке генетических конструкций, сотрудники направления «Нанобиомедицина» активно занимаются невирусной доставкой векторов. Вирусные системы доставки генов нашли широкое применение в медицинской практике [63–67], однако есть у них и недостатки — например, вызываемый ими иммунный ответ, который делает повторное применение того же вирусного вектора у одного пациента проблематичным. «В этом плане к невирусным системам доставки многие относятся как к очень перспективному препарату для генной терапии, с которым можно избежать ключевых проблем, присущих вирусным системам», — подчеркивает Максим Никитин.
Спецпроект «Биомолекулы» «Генная терапия» рассказывает о различных системах доставки генов, в том числе вирусных: «Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo» [68], «Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo» [69], «„Спутник V“ и не только: сказ об аденовирусных вакцинах» [70].
Невирусные наночастицы действительно предоставляют много вариантов доставки препарата. «Потенциально может оказаться, что доставка невирусными системами будет более функциональной и легко настраиваемой, чем любая вирусная», — поделился с нами Максим Никитин (подробности на рис. 11). — «Если использовать магнитные частицы, мы можем визуализировать место их доставки не только по экспрессии белка, но и по магнитному сигналу. Мы видим частицы в МРТ, а еще у нас есть и собственные технологии регистрации магнитных наночастиц в живом организме. Для детекции вирусных систем таких удобных, неинвазивных инструментов попросту не существует». Проведение полимеразной цепной реакции (ПЦР) [71], [72] потребовало бы колоссальных трудозатрат, а с помощью магнетизма, по словам Максима Никитина, один человек может обработать данные по десяткам животных за один день.
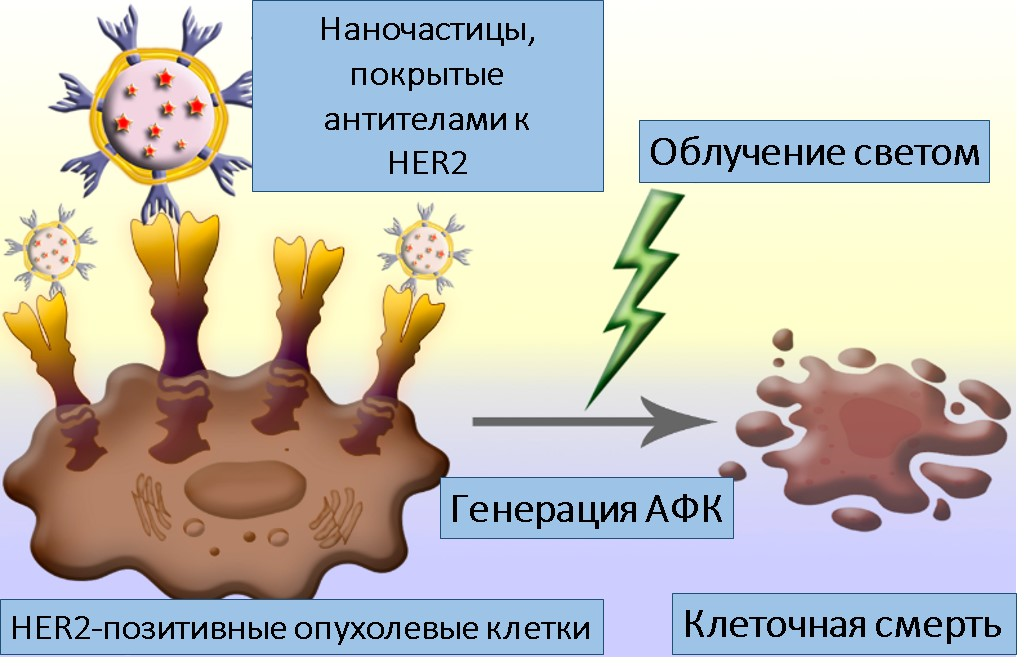
Рисунок 11. Полимерные наночастицы, покрытые HER2-распознающим белком, селективно связываются с опухолевыми клетками. Изнутри наночастицы заполнены флуоресцентным красителем, фотоактивируемым зеленым светом: при таком освещении краситель образует активные формы кислорода (АФК), вызывающие гибель раковых клеток.
В связи со всем вышесказанным, наночастицы на основе металл-органических полимерных каркасов (англ. MOF — Metal-organic Frameworks) стали одним из наиболее перспективных инструментов таргетной терапии. Они имеют пористую структуру и могут адсорбировать и высвобождать лекарственные соединения. Однако высокомолекулярные соединения загрузить в их мелкие поры достаточно трудно, а потому здесь доставка функциональных генов таким путем очень ограничена. И если молекулы РНК так доставлять все-таки пробовали, то плазмидную ДНК так вообще никто не доставлял. Тут исследователям «Сириуса» и их коллегам из МФТИ удалось разработать пионерную технологию модификации наночастиц для совместной загрузки туда и трансгена, и лекарственной молекулы, превратив их в мультимодальную систему (modMOF) [74].
Для изготовления таких наночастиц используется магнитное ядро, которое позволяет обнаружить их местонахождение в организме. Поверх ядра наращивают металлоорганическую каркасную оболочку, которая модифицируется несколькими полимерами, которые, с одной стороны, позволяют загрузить малые терапевтические молекулы внутрь частиц, а с другой — обеспечивают связывание плазмидной ДНК для трансфекции. В данном случае для модифицикации поверхности наночастиц был использован полиэтиленимин.
Эффективность вновь разработанных агентов была продемонстрирована in vitro для различных клеточных линий и in vivo при внутривенном введении мышам. Согласно исследованиям in vitro, дополнительная загрузка частиц плазмидной ДНК не повлияла на сорбцию и эффективность доставки лекарственных молекул.
Технология потенциально применима, например, при лечении заболеваний легких, онкологии и других сложных заболеваний, когда необходимо воздействовать сразу на несколько сигнальных путей. Например, при лечении онкологии со временем часто происходит экспансия, т.е. многократное деление устойчивых к лекарственным препаратам клеток, что не предвещает для больного ничего хорошего. Поэтому необходимо воздействовать на основные молекулярные пути, лежащие в основе канцерогенеза, одновременно, — ведь риск сразу нескольких мутаций, приводящих к множественной лекарственной устойчивости, в этом случае ниже. Для этого и необходимо такое устройство, способное доставить совместно несколько терапевтических средств.
«Умные» сверхчувствительные наноматериалы
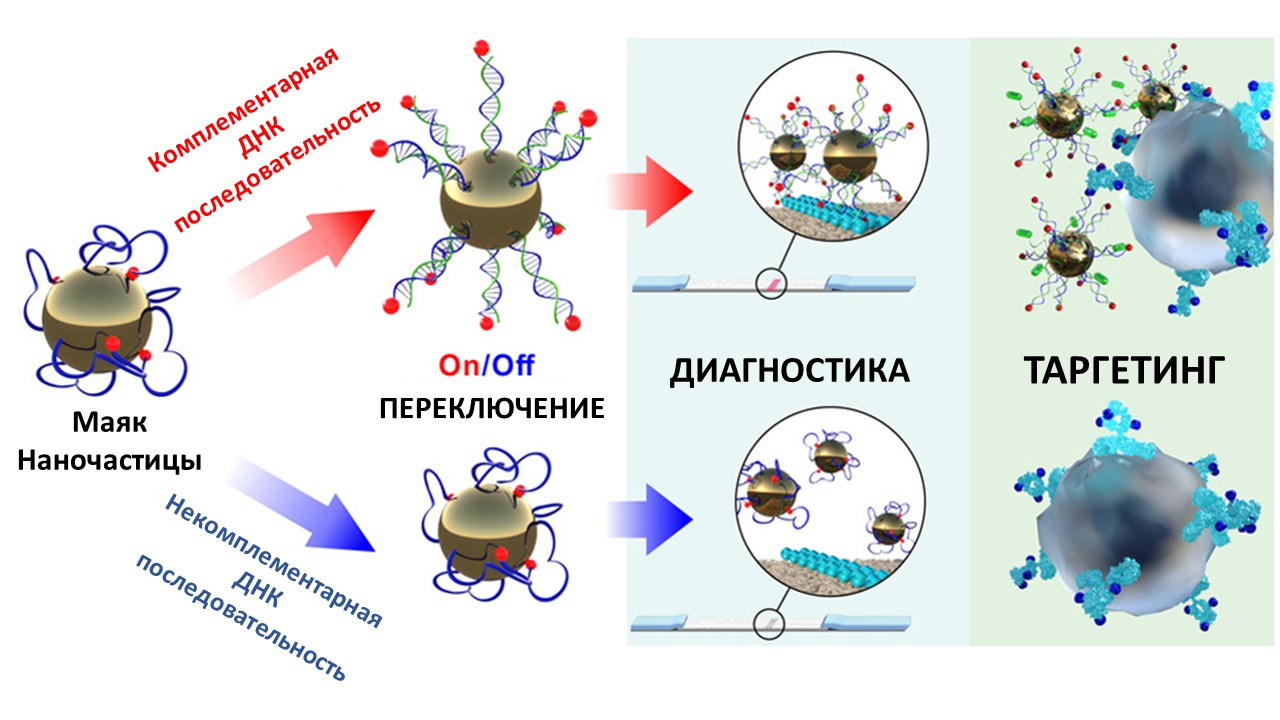
А что насчет таргетного терапевтического действия наночастиц? Можно ли сделать так, чтобы, попав в организм, они активировались только «по месту назначения», не вредя при этом здоровым клеткам? Мы уже упоминали, что такие механизмы существуют: некоторые наночастицы можно активировать, нагрев магнитным полем или изменив pH. Однако это достаточно примитивный механизм, а ведь хотелось бы прямо на месте отличить больную клетку от здоровой по молекулярным маркерам на ее поверхности. Проблема в том, что для таргетного распознавания мало одного маркера: почти все они, так или иначе, содержатся и в больных, и в здоровых клетках. Для увеличения специфичности доставки лекарств необходимы «умные» материалы, способные анализировать сразу несколько параметров своего окружения и действовать более точно. И ученые пошли дальше в своих попытках повторить элегантную сложность живых организмов и их способность реагировать на тонкие изменения среды.
Так, под руководством Максима Никитина вышла статья о новой технологии создания «умных» материалов, которые немного напоминают живые структуры своей способностью «включаться» или «выключаться» в ответ на определенные биомаркеры [75]. Эта работа стала естественным продолжением разработки биокомпьютерных материалов, созданных ранее Никитиным [76]: по сигналу «молекулярного включателя» эти материалы меняют пространственную архитектуру и реализуют свою функцию согласно правилам булевой алгебры. Тем не менее, несмотря на новый широкий функционал таких материалов, у них была проблема: чувствительность систем была невысока — и для ее преодоления исследователи разработали наноагенты, обладающие сверхчувствительностью к молекулам ДНК.
Если присмотреться к всем типам известных умных материалов, обычно они содержат несколько компонентов:
- рецептор для связи с мишенью (например, с клеткой);
- структура, обеспечивающая состояния «вкл.» (рецептор доступен для связывания) и «выкл.» (рецептор недоступен — например, попросту чем-то закрыт);
- «замок», сохраняющий эту конструкцию в одном из состояний, и который также можно разблокировать по сигналу «переключателя»;
- «переключатель», который распознает химический сигнал и открывает «защелку».
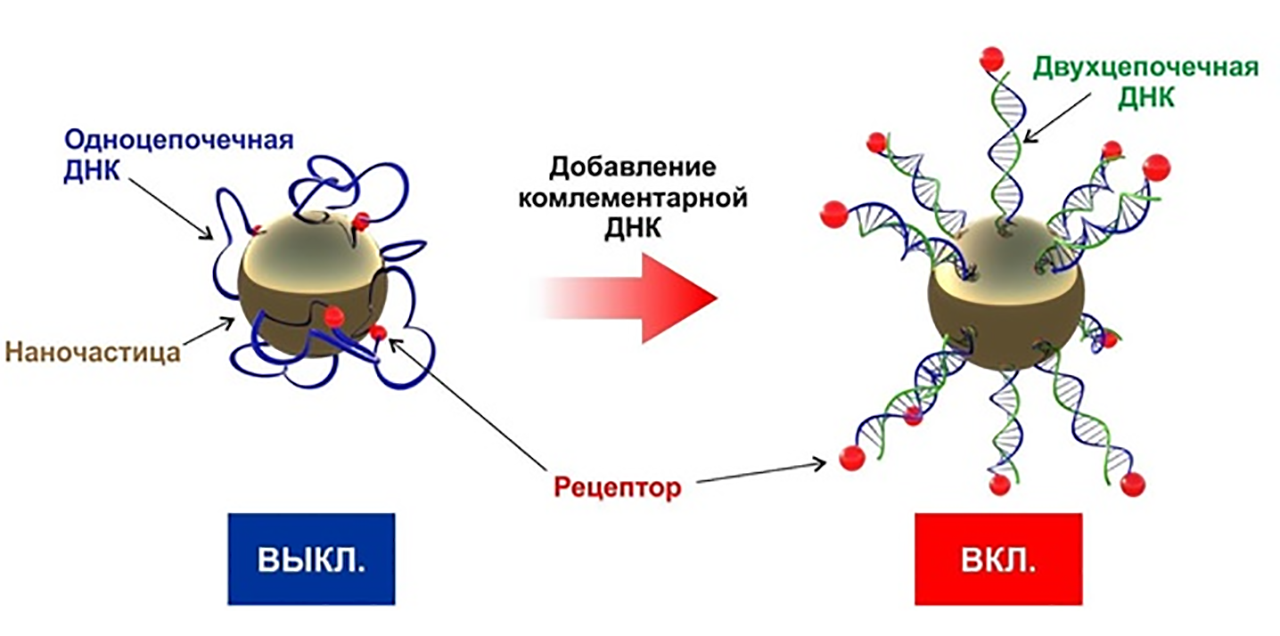
Проблема большинства ранее существовавших наноагентов была в том, что «переключатель» не может действовать отдельно от «замка». «Настроить» их по отдельности не получится, поэтому создатели таких агентов обычно «жертвовали» их чувствительностью. В новой концепции, представленной в статье [75], исследователи под руководством Максима Никитина предлагают разделить их и сделать «замок» полностью независимым от «переключателя» как химически, так и пространственно. Это позволяет повысить чувствительность материала в несколько раз. Свою концепцию сверхчувствительных наноагентов они назвали «маяками наночастиц», по аналогии с молекулярными маяками. Секрет этой конструкции в том, что рецептор присоединяется к наночастице через гибкий полимер, на котором расположен «переключатель». До поры до времени рецептор «спрятан» в свернутом полимере и не может взаимодействовать с лигандом. Эта конструкция напоминает язык хамелеона: при связывании с определенными молекулами «переключатель» активирует «замок», молекула полимера разворачивается, «отпирая» спрятанный внутри нее рецептор, который теперь может присоединиться к мишени (рис. 12).
Авторы исследования продемонстрировали способность таких наноагентов детектировать ДНК в исчезающе малой концентрации — порядка 30 фМ/л (фемто = 10−15). Кроме того, они продемонстрировали возможность распознавания раковых клеток в зависимости от содержания малых РНК в их микроокружении, а также возможность экспресс-ДНК-диагностики вне лабораторных условий.
Сейчас в «Сириусе» активно ведутся работы по совершенствованию технологии, ее масштабированию и разработке различных ее применений.
Как «продлить жизнь» наночастиц в организме?
На пути к безопасному применению в медицине наночастицам предстоит пройти через многочисленные исследования их деградации в организме. Ученые «Сириуса» с российскими коллегами применили разработанный ими уникальный магнитометрический подход для изучения этих процессов in vivo: в течение года они рассматривали, что происходит в организме с частицами оксида железа [77]. Оказывается, на длительность распада частиц влияет вводимая дозировка, поверхностное покрытие наночастиц и, самое главное, их внутренняя архитектура. Все эти данные необходимы для более рационального дизайна наночастиц.
Помимо разработки оптимальной структуры самих наноматериалов, стоит учесть еще и то, что организм очень эффективно вычищает эти наночастицы из себя при помощи мононуклеарных фагоцитов — время полувыведения из крови составляет менее 1 минуты! Есть несколько интересных стратегий, позволяющих «спрятаться» от моноцитов. Например, можно покрыть наночастицы полимерной оболочкой, защищающей от налипания белков и распознавания иммунными клетками [78], [79]. Однако это сильно сужает возможный функционал наноматериала. Другая стратегия заключается в «автостопе» на эритроцитах, которые живут в кровотоке порядка 120 дней: наночастицы можно загрузить внутрь них и вернуть обратно в кровоток, однако неясно, влияет ли это на основную функциональность наноагентов [80].
Ученые, однако, придумали более изящный способ — обмануть иммунитет! В исследовании, опубликованном в журнале Nature Biomedical Engineering, Максим Никитин с соавторами описали синтетические антитела, которыми можно пометить эритроциты, чтобы пустить моноциты по ложному следу, поскольку они начинают считать их чужаками [81]. На первый взгляд, немного рискованно, но, пожертвовав совсем небольшой долей эритроцитов (которые быстро восстановятся), можно одновременно увеличить время жизни наночастиц в кровотоке в десятки раз. И там, где в одиночку наночастицы не справлялись с опухолями грызунов, совместно с антиэритроцитарными антителами им это удалось. Если метод окажется удачным, можно будет снизить дозу наночастиц, вводимых в организм пациента, чтобы снизить ненужную нагрузку. «Если» — потому что потенциальные побочные эффекты от уничтожения части эритроцитов еще предстоит выяснить.
Направление «Нанобиомедицина» в «Сириусе» активно сотрудничает с Институтом биоорганической химии и Институтом общей физики, исследователи которого и разработали методологию детекции магнитных наноматериалов. «На данный момент в „Сириусе“ мы создаем новые наноматериалы для диагностики и перспективные наноматериалы для доставки лекарств, но тестируем их пока только in vitro, то есть занимаемся диагностической частью», — делится Максим Никитин. Сейчас все эксперименты in vivo проводятся на базе институтов-партнеров. После открытия лабораторного комплекса и собственного вивария планируется приступить к полномасштабной разработке терапевтических препаратов, в том числе проводить экспериментальные работы in vivo.
Наночастицы против антибиотикорезистентности
Какие еще возможности применения наночастиц рассматривают в «Сириусе»? Оказывается, в борьбе с антибиотикорезистентностью они тоже могут помочь. В последние годы проблема антибиотиков в современной медицине очевидна, и в качестве альтернативы активно обсуждаются бактериофаги . Фаговые препараты ведут свою историю с начала 20-го века, когда их впервые применили для лечения дизентерии, а затем — против холеры, брюшного тифа, пневмонии и многих других инфекций . Однако, несмотря на более чем столетнюю свою историю, фаготерапия так и не стала мейнстримом: высокая специфичность бактериофагов по отношению к конкретному штамму — как ключевое преимущество, так и серьезное ограничение для клинического применения. После выделения конкретного патогенного штамма микроорганизмов исследователи сталкиваются с необходимостью провести скрининг целой коллекции бактериофагов, насчитывающей порой десятки тысяч разновидностей. Всё дело в их природном разнообразии: попытка «вычислить» потенциально полезный фаг может сорвать все разумные сроки.
Фаготерапия, несмотря на потенциальную высокую эффективность, имеет целый ряд проблем: трудность в регистрации фаговых препаратов, в проведении клинических исследований, в адаптации результатов лабораторных исследований к крупномасштабному производству. Об этих и других проблемах фаготерапии «Биомолекула» рассказала в статье «Бактериофаги в медицине» [82] из одноименного спецпроекта.
Специфичность фага определяется его рецептор-связывающими белками, которые называют структурными деполимеразами, или хвостовыми шипами. Эти белки распознают молекулы, образующие клеточную стенку бактерий, или полисахариды капсулы. Быстрый и надежный скрининг фагов предполагает проверку специфичности фага или рекомбинантной деполимеразы, полученной из фага, к штамму, присутствующему у пациента. И такие методы есть: T-SPOT или реакция фермент-субстрат. Однако оба этих подхода требуют много времени и не отличаются высокой точностью. Дела обстояли бы иначе, если бы специфичный к бактериям фаг мог выделять сигнал физической природы, который гораздо проще зарегистрировать с помощью приборов.
Исследователи «Сириуса» сконструировали специальные наноагенты на основе частиц золота, имитирующие фаги и обладающие ферментативной активностью. Они были функционализированы белками деполимераз, а затем — добавлены к суспензии интересующих бактерий. После этого с помощью специальных оптический свойств золотых наночастиц (точнее, эффекта поверхностного плазмонного резонанса, ППР) изучалось поведение «псевдофагов» на поверхностях клеток (рис. 13).

Рисунок 13. Функционализация и специфическое взаимодействие наночастиц и бактериальных клеток.
(а) — функционализация наночастиц золота рекомбинантными деполимеразами.
(б) — специфическая сборка модифицированных наночастиц на поверхности A. baumannii, что приводит к смещению ППР.
Ферментативное разрушение бактериальной капсулы из-за активности деполимеразы приводит к разборке конъюгированных с деполимеразами наночастиц и обратному сдвигу ППР. При добавлении наночастиц, функционализированных неспецифическими белками, положение максимума ППР не меняется.
иллюстрация адаптирована из [83]
С помощью такого анализа удалось изучить, во-первых, специфичность наноагентов к бактериям и, во-вторых, в реальном времени их ферментативную активность по разрушению клеточной капсулы. Этот анализ позволяет значительно сократить процедуру сопоставления фагов и бактерий, а значит, может способствовать ускоренной разработке и внедрению фаговых препаратов в сложившейся с антибиотикорезистентностью ситуации. Недавно результаты работы коллектива под руководством Максима Никитина были опубликованы в престижном журнале Biosensors and Bioelectronics [83].
С чего начать свой путь в нанобиомедицине в «Сириусе»?
По словам руководителя направления, магистранты и аспиранты имеют возможность участвовать во всех исследованиях, которые проводятся по наномедицине в «Сириусе». «Наш коллектив выгодно отличается от многих других: мы гордимся, что мы занимаемся „полным циклом“ исследований. Абсолютно все аспекты наших проектов мы можем сделать сами — от неорганической и органической химии до исследований на клетках и животных», — делится Максим Никитин — «Но, кроме фундаментальной науки, нам интересны и прикладные разработки. Мы с сотрудниками нашего направления в „Сириусе“ основали компанию „Абисенс“ (резидент ИНТЦ „Сириус“), в которой разрабатываем и производим биологическое научное оборудование. Поэтому мы ищем в нашу команду и тех ребят, которым интересно поработать с животными и клетками, и тех, кому интересно создать какой-нибудь необычный физический метод исследования. У нас есть материалы, интересные не только для биологического направления».
Вот как Максим формулирует рецепт своего успеха:
Первое — не бояться рискнуть своим временем, а второе — стараться понять, что нужно обществу. Изначально я понимал, что могу написать бесконечное количество обзоров и статей, отчитаться по бесконечному количеству грантов, но это не моя цель, это средства для достижения цели. А реальная моя цель — желание изобрести принципиально новое лекарство. Свою первую значимую технологию я придумал в годы аспирантуры — работу опубликовали в высокоимпактном журнале Nature Nanotechnology [76], и это была гигантская инвестиция своего времени с колоссальным риском того, что ничего не получится. Мне несколько раз отказывали, но я смог доказать, что моя идея достойна такого журнала. Должна быть комбинация риска, осознания своих реальных возможностей и адекватной амбициозной задачи. Везение, безусловно, тоже должно быть, но оно должно быть верно «оцененным»: нужно понимать, сколько какой интенсивной работы надо сделать, чтобы реально добиться результата

Максим Никитин — к.ф.-м.н., руководитель направления «Нанобиомедицина», Лауреат Премии Президента РФ в области науки и инноваций для молодых ученых — 2017 «за разработку „умных“ наноматериалов нового поколения для биомедицинского применения и развитие фундаментальных основ автономных биомолекулярных вычислительных систем для тераностики», призер международного конкурса молодых инноваторов Falling Walls Young Innovator of the Year 2016, обладатель международной награды по биосенсорике Biosensors and Bioelectronics Award — 2016, с апреля 2020 г. включен в состав Президиума Совета при Президенте Российской Федерации по науке и образованию.
Заключение
Этой статьей мы завершаем спецпроект «Если звезды зажигают», посвященный самому молодому и амбициозному университету России. Мы пообщались с талантливыми учеными, ведущими свои исследования в стенах университета, и рассказали о научных центрах «Сириуса» [1]:
- Центре генетики и наук о жизни и о его направлениях — «Генетика» и «Биология и биотехнология растений»;
- Центре трансляционной медицины и его направлениях — «Биотехнология» и «Генная терапия»;
- Центре когнитивных исследований;
- Центре информационных технологий и искусственного интеллекта;
- Математическом центре.
Быть может, «Сириусу» предстоит стать новым вектором на российской научной арене. Исследования, проводящиеся в университете, перспективны как с медицинской точки зрения, так и по науке, так что ждем новых результатов! «Биомолекула» искренне надеется, что «Сириус», названный в честь звезды, еще не раз напомнит о себе открытиями и звездными выпускниками и преподавателями.
Литература
- Как живет и работает самый молодой вуз России — Университет «Сириус»;
- Сириус — двойная звезда науки: Биотехнология и Генная терапия;
- «Врачи-нанороботы» — миф или реальность?;
- Biomaterials Science — Elsevier, 2013;
- Gupta R., Gupta N., Weber K. K. Dental Implants. StatPearls Publishing, 2022.;
- Sarah Forward, Sheldon J. J. Kwok, Seok-Hyun Yun. (2019). Bioresorbable spectrometers. Nat Biomed Eng. 3, 594-595;
- Инженерная биомеханика: материалы имплантатов в России сегодня;
- Тканевая инженерия — окно в современную медицину;
- Barbara Zavan, Chiara Gardin, Vincenzo Guarino, Tiberio Rocca, Iriczalli Cruz Maya, et. al.. (2021). Electrospun PCL-Based Vascular Grafts: In Vitro Tests. Nanomaterials. 11, 751;
- «Большой брат следит за тобой», или Как развитие технологий меняет нашу жизнь;
- Киборги среди нас;
- Мобильные технологии для жизни и спорта;
- Nikolay A. Barinov, Anna P. Tolstova, Egor A. Bersenev, Dmitry A. Ivanov, Evgeniy V. Dubrovin, Dmitry V. Klinov. (2021). Molecular patterns of oligopeptide hydrocarbons on graphite. Colloids and Surfaces B: Biointerfaces. 206, 111921;
- Атомно-силовая микроскопия: увидеть, прикоснувшись;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Проблема выбора пептидов для «ЭпиВакКороны» и разбор статьи разработчиков вакцины о клинических испытаниях первой и второй фаз;
- V. G. Krut, I. V. Astrakhantseva, S. A. Chuvpilo, G. A. Efimov, S. G. Ambaryan, et. al.. (2022). Antibodies to the N-Terminal Domain of Angiotensin-Converting Enzyme (ACE2) That Block Its Interaction with SARS-CoV-2 S Protein. Dokl Biochem Biophys. 502, 1-4;
- В. Г. Круть, И. В. Астраханцева, С. А. Чувпило, Г. А. Ефимов, С. Г. Амбарян, et. al.. (2022). АНТИТЕЛА К N-КОНЦЕВОМУ ДОМЕНУ АНГИОТЕНЗИН-КОНВЕРТИРУЮЩЕГО ФЕРМЕНТА (АСЕ2) БЛОКИРУЮТ ЕГО ВЗАИМОДЕЙСТВИЕ С S БЕЛКОМ ВИРУСА SARS-CoV-2. Доклады Российской академии наук. Науки о жизни. 502, 5-9;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- I. Astrakhantseva, E. Vasilenko, A. Babaev, E. Gubernatorova, E. Gorshkova, et. al.. (2018). In Search for the Genes Associated with Septic Shock Using Direct Genetic Approach. rimm. 579-585;
- I. V. Astrakhantseva, L. S. Gladkova, E. A. Vasilenko, V. S. Tarabykin, M. S. Drutskaya, S. A. Nedospasov. (2020). NEW STRAIN OF MUTANT MICE CHARACTERIZED BY SELECTIVE RESISTANCE TO ONE OF TWO SEPTIC SHOCK PROTOCOLS. Russian Journal of Immunology. 23, 27-34;
- Ivan R. Minev, Pavel Musienko, Arthur Hirsch, Quentin Barraud, Nikolaus Wenger, et. al.. (2015). Electronic dura mater for long-term multimodal neural interfaces. Science. 347, 159-163;
- Nikolaus Wenger, Eduardo Martin Moraud, Jerome Gandar, Pavel Musienko, Marco Capogrosso, et. al.. (2016). Spatiotemporal neuromodulation therapies engaging muscle synergies improve motor control after spinal cord injury. Nat Med. 22, 138-145;
- Grégoire Courtine, Rubia van den Brand, Pavel Musienko. (2011). Spinal cord injury: time to move. The Lancet. 377, 1896-1898;
- Grégoire Courtine, Yury Gerasimenko, Rubia van den Brand, Aileen Yew, Pavel Musienko, et. al.. (2009). Transformation of nonfunctional spinal circuits into functional states after the loss of brain input. Nat Neurosci. 12, 1333-1342;
- Pavel E. Musienko, Vladimir F. Lyalka, Oleg V. Gorskii, Pavel V. Zelenin, Tatiana G. Deliagina. (2022). Activity of Spinal Interneurons during Forward and Backward Locomotion. J. Neurosci.. 42, 3570-3586;
- Natalia Merkulyeva, Aleksandr Veshchitskii, Oleg Gorsky, Natalia Pavlova, Pavel V. Zelenin, et. al.. (2018). Distribution of Spinal Neuronal Networks Controlling Forward and Backward Locomotion. J. Neurosci.. 38, 4695-4707;
- Evgeniya V. Efimova, Saveliy R. Kuvarzin, Mikael S. Mor, Nataliia V. Katolikova, Taisiia S. Shemiakova, et. al.. (2022). Trace Amine-Associated Receptor 2 Is Expressed in the Limbic Brain Areas and Is Involved in Dopamine Regulation and Adult Neurogenesis. Front. Behav. Neurosci.. 16;
- Rubia van den Brand, Janine Heutschi, Quentin Barraud, Jack DiGiovanna, Kay Bartholdi, et. al.. (2012). Restoring Voluntary Control of Locomotion after Paralyzing Spinal Cord Injury. Science. 336, 1182-1185;
- Nadia Dominici, Urs Keller, Heike Vallery, Lucia Friedli, Rubia van den Brand, et. al.. (2012). Versatile robotic interface to evaluate, enable and train locomotion and balance after neuromotor disorders. Nat Med. 18, 1142-1147;
- Nikolaus Wenger, Eduardo Martin Moraud, Stanisa Raspopovic, Marco Bonizzato, Jack DiGiovanna, et. al.. (2014). Closed-loop neuromodulation of spinal sensorimotor circuits controls refined locomotion after complete spinal cord injury. Sci. Transl. Med.. 6;
- Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить;
- AlanA. Boulton. (1974). AMINES AND THEORIES IN PSYCHIATRY. The Lancet. 304, 52-53;
- Beth Borowsky, Nika Adham, Kenneth A. Jones, Rita Raddatz, Roman Artymyshyn, et. al.. (2001). Trace amines: Identification of a family of mammalian G protein-coupled receptors. Proc. Natl. Acad. Sci. U.S.A.. 98, 8966-8971;
- Дофаминовые болезни;
- Тайны голубого пятна;
- Серотониновые сети;
- T BRANCHEK, T BLACKBURN. (2003). Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Current Opinion in Pharmacology. 3, 90-97;
- Mark D. Berry, Raul R. Gainetdinov, Marius C. Hoener, Mohammed Shahid. (2017). Pharmacology of human trace amine-associated receptors: Therapeutic opportunities and challenges. Pharmacology & Therapeutics. 180, 161-180;
- D. S. Kalinina, M. A. Ptukha, A. V. Goriainova, N. S. Merkulyeva, A. A. Kozlova, et. al.. (2021). Role of the trace amine associated receptor 5 (TAAR5) in the sensorimotor functions. Sci Rep. 11;
- Evgeniya V. Efimova, Alena A. Kozlova, Valeria Razenkova, Nataliia V. Katolikova, Kristina A. Antonova, et. al.. (2021). Increased dopamine transmission and adult neurogenesis in trace amine-associated receptor 5 (TAAR5) knockout mice. Neuropharmacology. 182, 108373;
- Junko Ito, Masahiko Ito, Hirohide Nambu, Toru Fujikawa, Kenichi Tanaka, et. al.. (2009). Anatomical and histological profiling of orphan G-protein-coupled receptor expression in gastrointestinal tract of C57BL/6J mice. Cell Tissue Res. 338, 257-269;
- A. Babusyte, M. Kotthoff, J. Fiedler, D. Krautwurst. (2013). Biogenic amines activate blood leukocytes via trace amine-associated receptors TAAR1 and TAAR2. Journal of Leukocyte Biology. 93, 387-394;
- Raul R. Gainetdinov, Marius C. Hoener, Mark D. Berry. (2018). Trace Amines and Their Receptors. Pharmacol Rev. 70, 549-620;
- Damien Dupré, Eva G. Krumhuber, Dennis Küster, Gary J. McKeown. (2020). A performance comparison of eight commercially available automatic classifiers for facial affect recognition. PLoS ONE. 15, e0231968;
- Nadine Bakkar, Tina Kovalik, Ileana Lorenzini, Scott Spangler, Alix Lacoste, et. al.. (2018). Artificial intelligence in neurodegenerative disease research: use of IBM Watson to identify additional RNA-binding proteins altered in amyotrophic lateral sclerosis. Acta Neuropathol. 135, 227-247;
- От живого мозга к искусственному интеллекту;
- Dmitrii V. Bozhko, Vladislav O. Myrov, Sofia M. Kolchanova, Aleksandr I. Polovian, Georgii K. Galumov, et. al.. (2022). Artificial intelligence-driven phenotyping of zebrafish psychoactive drug responses. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 112, 110405;
- Трансляционная психиатрия — как моделировать психические расстройства на животных?;
- Модельные организмы: данио рерио;
- Проблемы, тренды и точки роста доклинических исследований;
- Andréia B. Moraes, Ana C.V.V. Giacomini, Rafael Genario, Leticia Marcon, Naiara Scolari, et. al.. (2021). Pro-social and anxiolytic-like behavior following a single 24-h exposure to 17β-estradiol in adult male zebrafish. Neuroscience Letters. 747, 135591;
- Ana C.V.V. Giacomini, Naiara Scolari, Leticia Marcon, Barbara W. Bueno, Bruna E. dos Santos, et. al.. (2021). Putative anxiolytic-like behavioral effects of acute paracetamol in adult zebrafish. Behavioural Brain Research. 409, 113293;
- Murilo S. de Abreu, Ana C.V.V. Giacomini, Konstantin A. Demin, David S. Galstyan, Konstantin N. Zabegalov, et. al.. (2021). Unconventional anxiety pharmacology in zebrafish: Drugs beyond traditional anxiogenic and anxiolytic spectra. Pharmacology Biochemistry and Behavior. 207, 173205;
- Что такое нейропротезирование? Это вредно?;
- Joseph P. Roche, Marlan R. Hansen. (2015). On the Horizon. Otolaryngologic Clinics of North America. 48, 1097-1116;
- Andrew C. Weitz, Devyani Nanduri, Matthew R. Behrend, Alejandra Gonzalez-Calle, Robert J. Greenberg, et. al.. (2015). Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Sci. Transl. Med.. 7;
- M.N. Barshutina, S.O. Kirichenko, V.A. Wodolajsky, A.V. Lopachev, S.N. Barshutin, et. al.. (2022). PDMS-CNT composite for soft bioelectronic neuronal implants. Composites Part B: Engineering. 247, 110286;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Наночастицы — инструмент адресной доставки лекарств;
- Shichao Zhu, Kai Zhu, Jun Li, Hao Lai, Chunsheng Wang. (2020). Nano-Biomaterials for the Delivery of Therapeutic and Monitoring Cues for Aortic Diseases. Front. Bioeng. Biotechnol.. 8;
- Хубутия Ш., Бабич А. В., Темнов А. А., Ботин А. С., Попова Т. С. (2012). Применение наноматериалов в медицине. Часть 1. Российский медицинский журнал, 5. — 53–56 с.;
- Fuminori Sakurai, Masashi Tachibana, Hiroyuki Mizuguchi. (2022). Adenovirus vector-based vaccine for infectious diseases. Drug Metabolism and Pharmacokinetics. 42, 100432;
- Marwa Alhashimi, Ahmed Elkashif, Ekramy E. Sayedahmed, Suresh K. Mittal. (2021). Nonhuman Adenoviral Vector-Based Platforms and Their Utility in Designing Next Generation of Vaccines for Infectious Diseases. Viruses. 13, 1493;
- Ian R. Humphreys, Sarah Sebastian. (2018). Novel viral vectors in infectious diseases. Immunology. 153, 1-9;
- Nia Tatsis, Hildegund C.J. Ertl. (2004). Adenoviruses as vaccine vectors. Molecular Therapy. 10, 616-629;
- Cecilia Larocca, Jeffrey Schlom. (2011). Viral Vector-Based Therapeutic Cancer Vaccines. The Cancer Journal. 17, 359-371;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- 12 методов в картинках: полимеразная цепная реакция;
- Цифровая ПЦР: измеряя истину;
- Victoria Olegovna Shipunova, Anna Samvelovna Sogomonyan, Ivan Vladimirovich Zelepukin, Maxim Petrovich Nikitin, Sergey Mikhailovich Deyev. (2021). PLGA Nanoparticles Decorated with Anti-HER2 Affibody for Targeted Delivery and Photoinduced Cell Death. Molecules. 26, 3955;
- A. Ringaci, A.V. Yaremenko, K.G. Shevchenko, S.D. Zvereva, M.P. Nikitin. (2021). Metal-organic frameworks for simultaneous gene and small molecule delivery in vitro and in vivo. Chemical Engineering Journal. 418, 129386;
- Vladimir R. Cherkasov, Elizaveta N. Mochalova, Andrey V. Babenyshev, Alexandra V. Vasilyeva, Petr I. Nikitin, Maxim P. Nikitin. (2020). Nanoparticle Beacons: Supersensitive Smart Materials with On/Off-Switchable Affinity to Biomedical Targets. ACS Nano. 14, 1792-1803;
- Maxim P. Nikitin, Victoria O. Shipunova, Sergey M. Deyev, Petr I. Nikitin. (2014). Biocomputing based on particle disassembly. Nature Nanotech. 9, 716-722;
- Ivan V. Zelepukin, Alexey V. Yaremenko, Ilya N. Ivanov, Mikhail V. Yuryev, Vladimir R. Cherkasov, et. al.. (2021). Long-Term Fate of Magnetic Particles in Mice: A Comprehensive Study. ACS Nano. 15, 11341-11357;
- Zohreh Amoozgar, Yoon Yeo. (2012). Recent advances in stealth coating of nanoparticle drug delivery systems. WIREs Nanomed Nanobiotechnol. 4, 219-233;
- Susanne Schöttler, Greta Becker, Svenja Winzen, Tobias Steinbach, Kristin Mohr, et. al.. (2016). Protein adsorption is required for stealth effect of poly(ethylene glycol)- and poly(phosphoester)-coated nanocarriers. Nature Nanotech. 11, 372-377;
- I. V. Zelepukin, A. V. Yaremenko, V. O. Shipunova, A. V. Babenyshev, I. V. Balalaeva, et. al.. (2019). Nanoparticle-based drug delivery via RBC-hitchhiking for the inhibition of lung metastases growth. Nanoscale. 11, 1636-1646;
- Maxim P. Nikitin, Ivan V. Zelepukin, Victoria O. Shipunova, Ilya L. Sokolov, Sergey M. Deyev, Petr I. Nikitin. (2020). Enhancement of the blood-circulation time and performance of nanomedicines via the forced clearance of erythrocytes. Nat Biomed Eng. 4, 717-731;
- Бактериофаги в медицине;
- A. Ringaci, K.G. Shevchenko, I.V. Zelepukin, A.V. Popova, M.P. Nikitin. (2022). Phage-mimicking nanoagents for rapid depolymerase specificity screening against multidrug resistant bacteria. Biosensors and Bioelectronics. 213, 114444.