
Клеточные технологии в регенеративной медицине
07 февраля 2025
Клеточные технологии в регенеративной медицине
- 2117
- 0
- 11
Клеточные технологии начинают активно использоваться в медицине для лечения самых разнообразных заболеваний — от повреждений суставов до дегенеративных заболеваний головного мозга.
Рисунок в оригинальном разрешении.
иллюстрация Александры Мартыновой
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Регенеративная способность млекопитающих, в том числе человека, зависит от стадии развития — максимальна она в пренатальном периоде. А с возрастом, к сожалению, ткани человека регенерируют всё слабее: полностью восстановить функцию органа в результате серьезных заболеваний или повреждений, увы, не получается. Долгое время медицина могла предложить лишь один вариант лечения — заменить поврежденный орган на новый (трансплантация). Но донорских органов не хватает для всех нуждающихся, и к тому же часто они несовместимы иммунологически. Но мы стоим на пороге новых открытий в регенеративной медицине благодаря достижениям молекулярной и клеточной биологии — в продолжении нашего спецпроекта поговорим о клеточных технологиях.
Регенеративная медицина

Медицина без преувеличения преобразила жизнь всего человечества, позволив спасать от ран и лечить от болезней, в том числе — в недавнем прошлом неизлечимых. И хотя ее развитие не прекращается, в отдельную новую дисциплину выделяют медицину регенеративную, цель которой — восстанавливать повреждения тканей и органов, а также продлевать их бесперебойную работу, активируя внутренний регенеративный потенциал организма. Применение в реальной клинической практике стволовых клеток и компонентов их секретома; тканевая инженерия; активация обновления и регенерации клеток — уже реальность или пока отдаленная фантастика?
Партнер проекта — российская фармацевтическая компания «Биотехфарм», занимающаяся поставкой и продвижением лекарственных средств и изделий медицинского назначения в сфере гинекологии, урологии и репродуктивной медицины. Компания продвигает высокотехнологичные препараты, в том числе на основе цитокинов, секретомов, гиалуроновой кислоты и лактобактерий.
Главные препараты компании — «Суперлимф®», созданный на кафедре иммунологии РНИМУ им. Н.И. Пирогова, применяющийся для регенеративного лечения раневых поверхностей и инфекционных заболеваний урогенитального тракта; а также средства для интимной гигиены — «Эстрогиал™» и «Ацилакт ДУО».
Клеточная терапия — это введение человеку живых клеток для достижения лечебного или профилактического эффекта. «Биомолекула» уже не раз рассматривала клеточные технологии в своих спецпроектах и отдельных статьях. Для того, чтобы иметь целостное представление о теме, прежде всего рекомендуем почитать «12 методов в картинках: клеточные технологии» [1], а затем перейти к публикации «Генная терапия: познакомьтесь с лекарствами будущего» [2].
Эта статья тесно связана с предыдущей публикацией Спецпроекта по регенеративной медицине: «Тканевая инженерия и что она может предложить сегодня» [3]: сейчас мы углубимся в практические аспекты и рассмотрим применение стволовых клеток в медицинской практике более детально. Узнаем, что их использование открывает совершенно новые возможности для восстановления тканей и органов, утраченных в результате травмы, болезни или старения. Постараемся понять, какие результаты в практической медицине уже достигнуты и над чем предстоит еще активно поработать.
Как происходит восстановление поврежденных тканей в организме человека?
Человек состоит из триллионов клеток различных типов — это микроскопические строительные блоки для всех тканей организма, которые постоянно растут и специализируются, функционируют, умирают и делятся миллионами каждую секунду. Процесс самообновления и поддержания структуры организма называется регенерацией. Само это слово относится как к регулярному клеточному обновлению органа или ткани на протяжении всей жизни организма (физиологическая регенерация), так и к восстановлению поврежденной ткани или утраченных частей тела (репаративная регенерация) [4].
С практической точки зрения регенеративное направление в медицине — самое сложное, поскольку млекопитающие (в частности, люди) регенерируют куда хуже других, проще устроенных видов, и к тому же эта способность снижается с возрастом. Хронические, аутоиммунные и дегенеративные заболевания усугубляют эту ситуацию, нарушая как физиологическую, так и репаративную регенерацию.
Функциональным элементом регенерации являются недифференцированные стволовые клетки (СК) или же специализированные клетки, которые могут вступить в дедифференцировку или трансдифференцировку [5]. В соответствии со своим потенциалом и специфическими стимулами, СК могут приобретать фенотип нервных клеток, кардиомиоцитов, клеток печени и других, которые необходимы для восстановления [6]. Прежде чем обсуждать терапевтические вмешательства, предлагаем рассмотреть физиологические резервы обновления человеческого организма — см. во врезке.
Роль и виды стволовых клеток в регенеративной медицине
Еще раз напомним: СК — это клетки, которые могут давать начало другим клеткам организма [35]. Все СК обладают сразу двумя чертами: они способны к самообновлению и могут переходить в другие клеточные типы — свойство дифференцировки). Иногда можно встретить термины «клетки-предшественники» или «прогениторные клетки», но отличаются они от стволовых тем, что у них нет потенциала к самообновлению — они лишь способны давать начало новым клеткам [36].
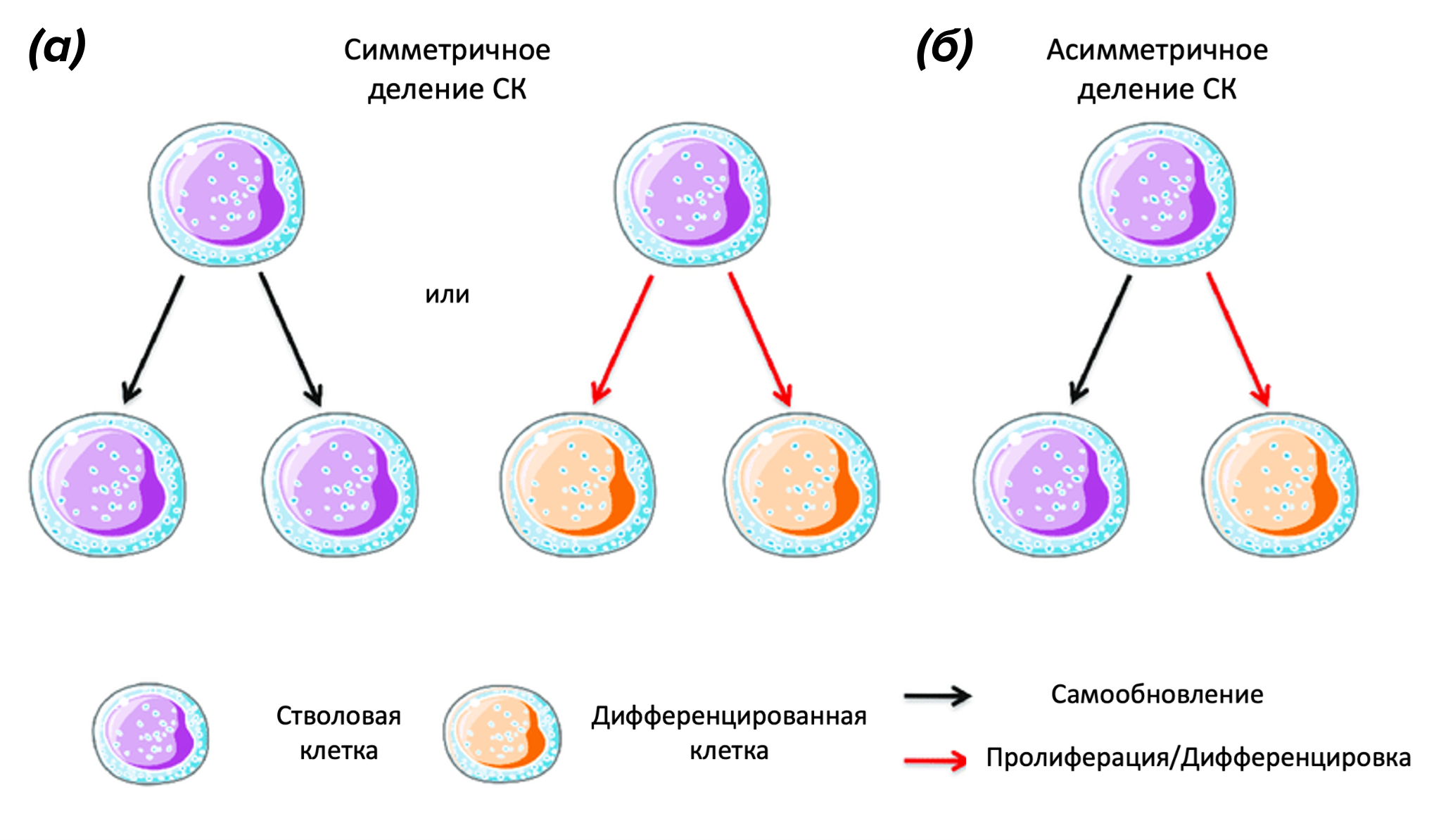
Рисунок 1. Разные типы деления стволовых клеток. (а) — симметричное: возникают две дочерние клетки — либо обе стволовые, либо обе дифференцированные. (б) — асимметричное: возникает одна стволовая клетка и одна дифференцированная.
Все СК можно классифицировать по потенциалу дифференцировки (табл. 1). Свойства тоти- и плюрипотентности характерны для ранних стадий развития организма (за исключением индуцированных стволовых клеток, о которых речь пойдет ниже). СК, полученные из пуповинной крови, иногда ошибочно считают эмбриональными стволовыми клетками; но на самом деле они являются соматическими. Взрослые соматические стволовые клетки могут быть мульти-, олиго- и унипотентными [38].
| Тип стволовой клетки | Какие клетки могут образоваться | Примеры стволовых клеток |
|---|---|---|
| Тотипотентая | Эмбриональные и экстраэмбриональные ткани (амнион, желточный мешок, хорион) | Клетки, образовавшиеся в результате первых нескольких делений зиготы |
| Плюрипотентная | Любые клетки самого организма | Внутренние клетки бластоцисты, эмбриональные стволовые клетки, индуцированные стволовые клетки |
| Мультипотентная | Только клетки одного зародышевого слоя или клетки одной ткани | Гемопоэтические стволовые клетки |
| Олигопотентная | Только некоторые клетки внутри одной ткани | Лимфоидные и миелоидные клетки |
| Унипотентная | Только клетки определенного типа | Эпидермальные стволовые клетки |
«Я родился!» Происхождение СК
Существует три основных типа СК: эмбриональные, взрослые (соматические) и индуцированные плюрипотентные (ИПСК) [39].
Эмбриональные стволовые клетки (ЭСК) получают из преимплантационной бластоцисты (через 7–10 дней после оплодотворения). Каждая ЭСК способна стать полноценным эмбрионом. В настоящий момент ЭСК активно используются для генетического тестирования: для этого забирают одну клетку из развивающегося эмбриона, полученного в результате экстракорпорального оплодотворения (ЭКО) [40]. Такое тестирование ЭСК разных эмбрионов позволяет выбрать только те из них, у которых отсутствуют генетические аномалии — для последующего переноса в матку. В силу своей плюрипотентности ЭСК являются ценным источником материала для изучения процессов развития и связанных с ними расстройств, однако этические вопросы ограничивают применение ЭСК в медицине и научных исследованиях [41].
Соматические стволовые клетки (иногда называемые тканеспецифическими или взрослыми СК), как полагают, присутствуют в большинстве тканей и сохраняются на протяжении всей жизни, играя роль в поддержании, восстановлении и регенерации тканей. Они особенно важны для тканей с высоким пролиферативным потенциалом, таких как кровь, кожа и кишечник [42]. Один из типов взрослых СК — эпителиальные, которые дают начало кератиноцитам в эпидермисе кожи. Костный мозг же имеет сразу три различных типа СК:
- гемопоэтические, дающие начало эритроцитам, лейкоцитам и тромбоцитам;
- эндотелиальные, порождающие эндотелиальные клетки, выстилающие кровеносные и лимфатические сосуды; и
- мезенхимальные стволовые клетки (МСК) [39], которые могут дифференцироваться в клетки нескольких линий, такие как хондроциты, остеобласты, адипоциты, миобласты. Эти мультипотентные МСК можно обнаружить практически во всех тканях, но в основном они располагаются в околососудистых пространствах [43].
В 2006 году японский ученый Синъя Яманака с коллегами впервые внедрили в зрелую клетку гены, кодирующие факторы транскрипции плюрипотентных ЭСК. Небольшое количество зрелых клеток вернулось (дедифференцировалось) в незрелое состояние, напоминающее ЭСК. Так удалось получить индуцированные плюрипотентные стволовые клетки (ИПСК) (рис. 2). Подробнее об их открытии и получении можно узнать в статьях: «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [44] и «Была клетка простая, стала стволовая» [45].
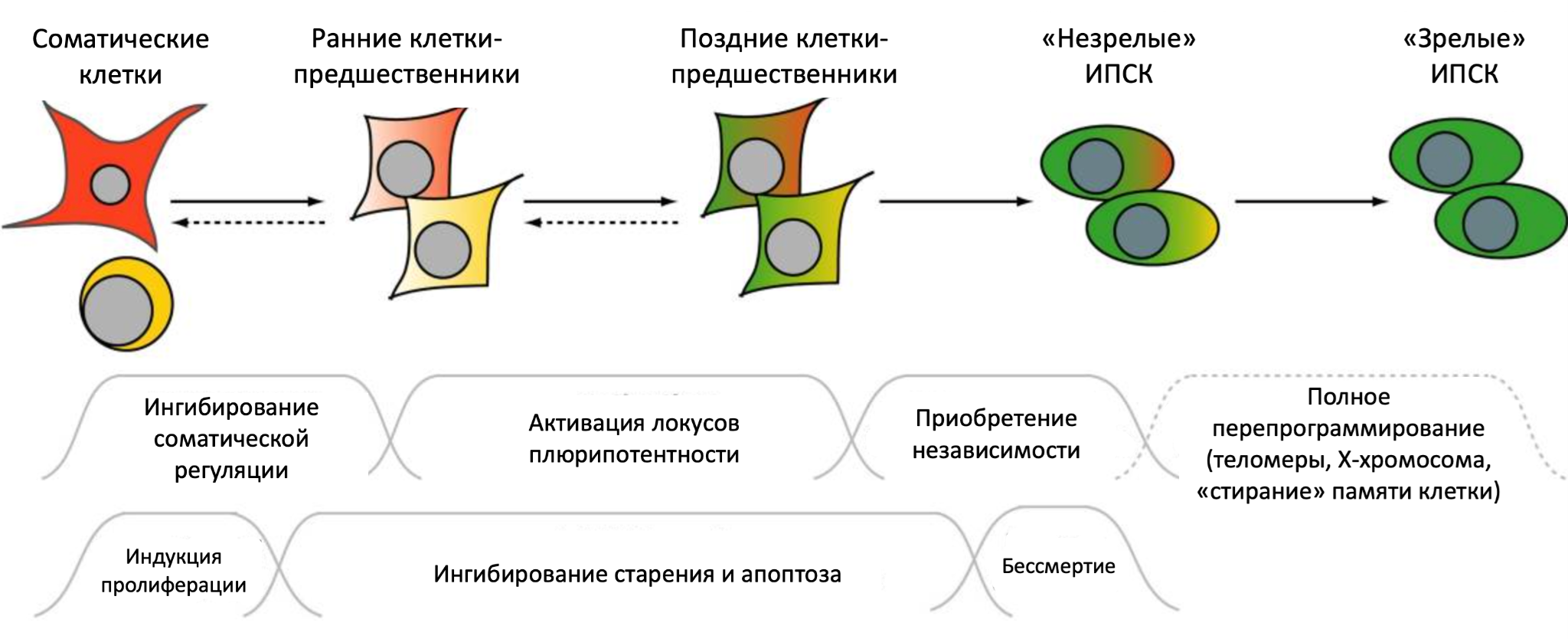
Рисунок 2. Переход соматических клеток в ИПСК. Ранние этапы обратимы, на что указывают пунктирные стрелки. «Незрелые ИПСК» — клетки, которые уже приобрели плюрипотентность, но всё еще сохраняют память о своей специализации, в то время как «зрелые ИПСК» ее уже утрачивают. Подписи внизу указывают на обязательные этапы репрограммирования, которые клетки должны пройти на разных стадиях. Неспособность преодолеть любое из этих препятствий может привести к тому, что клетки остановятся на определенной стадии или погибнут.
Возможность создания ИПСК указывает на то, что все клетки организма обладают пластичностью: любая клетка может быть «перекодирована» в клетку другого типа. ИПСК могут быть использованы для «персонализированной» лекарственной терапии различных дегенеративных заболеваний, так как представляют источник иммунологически идентичных клеток для трансплантации (так называемая аутотрансплантация). О клеточной терапии в медицине поговорим немного позже, а сейчас уделим внимание перспективному способу получения ИПСК — с помощью «коктейля» малых молекул.
Малые, да удалые!
Довольно интересен ответ вопрос: «Откуда СК знает, какой именно клеткой ей нужно стать?» Она «принимает решение» дифференцироваться в более зрелый тип клеток в зависимости от нескольких факторов:
- определенные типы биологических и химических веществ в клетке;
- внеклеточные сигналы (белковые молекулы, гормоны и др.);
- клеточное микроокружение;
- физические свойства среды, которые влияют на клетку [47].
При использовании клеточной терапии наиболее важным шагом является направленная дифференциация СК в нужную сторону. Это может быть достигнуто путем имитации сигнальных путей и микросреды во время перепрограммирования соматических клеток.
Мы уже кратко обсудили, что ИПСК впервые были получены (и с некоторыми модификациями метода получаются до сих пор) путем векторного переноса генов четырех факторов транскрипции (Oct-3/4, Sox2, KLF4 и c-Myc) [45]. Эти факторы могут индуцировать плюрипотентность, позволяя дифференцированным клеткам развиваться в любой специализированный тип [48]. Гены перепрограммирования в клетки-мишени обычно переносятся вирусами; однако включение в человеческую ДНК части вирусного генома несет риск возникновения онкологических заболеваний, а к тому же эта процедура довольно часто малоэффективна.
Для решения этих проблем исследователи решили использовать малые молекулы, которые имитируют действие факторов транскрипции и направляют трансформацию соматических клеток в ИПСК [49] (рис. 3).

Рисунок 3. Утопическое представление того, как может выглядеть репрограммирование соматических клеток с помощью малых молекул.
иллюстрация Александры Мартыновой
Существует множество протоколов создания клеток каждого типа организма с использованием разнообразных малых молекул. Зачастую используются «коктейли» молекул в определенной последовательности и концентрации, которые приводят как к активации, так и к дезактивации определенных сигнальных путей на разных стадиях развития (рис. 4) [50], [51]. Может возникнуть вопрос: как же малые молекулы вообще могут перепрограммировать клетки, если обычно этот процесс управляется факторами транскрипции — белками, взаимодействующими с ДНК и влияющими на считывание с нее информации? Дело в том, что можно воздействовать на сигнальные пути, приводящие к повышению или понижению уровней этих факторов в клетке. Например, малая молекула RepSox может ингибировать TGFβ, что приводит к повышению уровня Sox2, а форсколин активирует сАМР, что повышает уровень Oct4. Поскольку малые молекулы, конечно, не эквивалентны белкам, и при их воздействии затрагиваются и другие сигнальные пути, то, чтобы добиться того же эффекта, что и от четырех «белков Яманаки», требуются более сложные комбинации молекул. Их подбирают эмпирически, чтобы результирующий эффект был похож на непосредственное действие транскрипционных факторов.
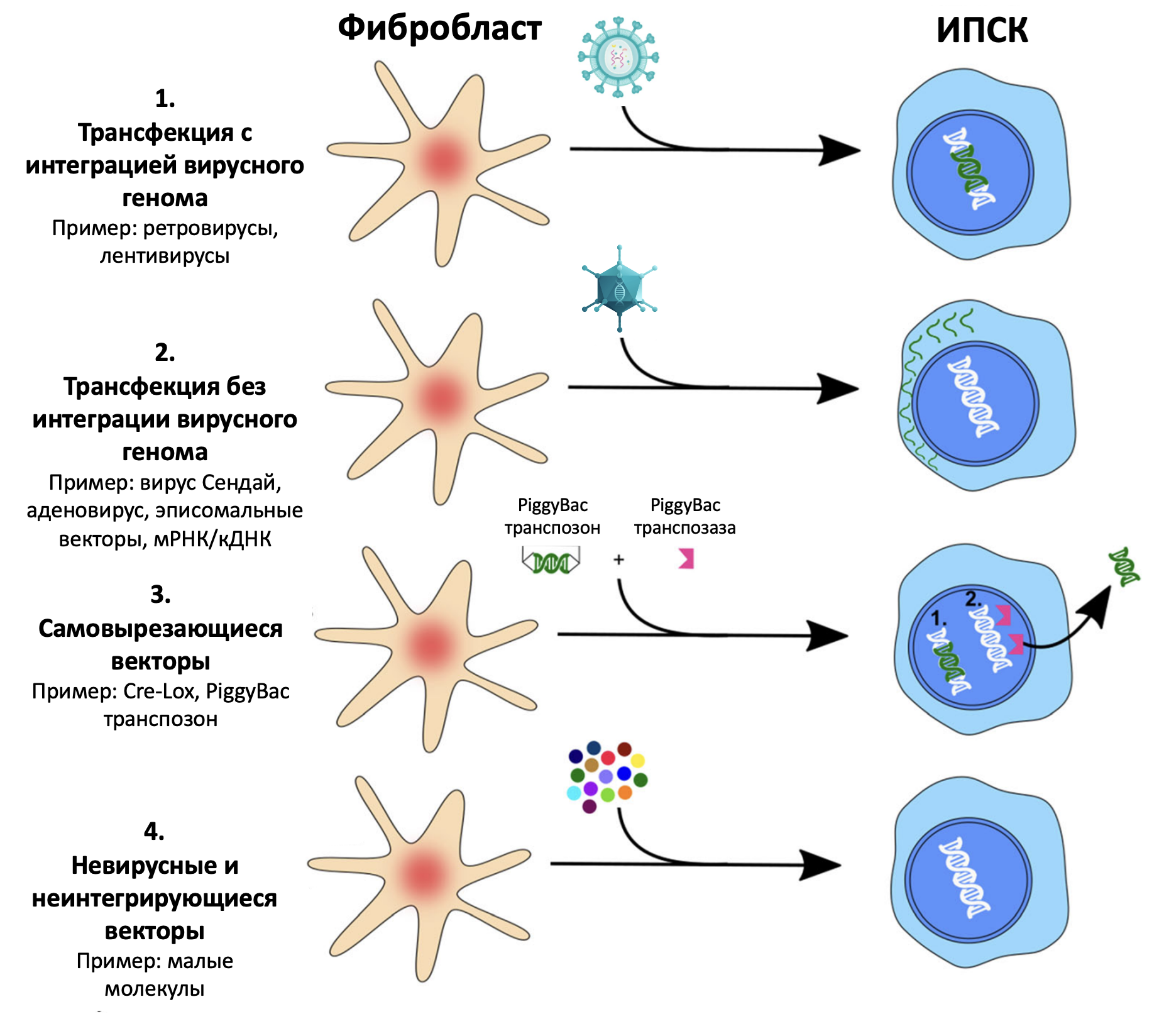
Рисунок 4. Четыре основных метода перепрограммирования клеток в ИПСК. 1. Вирусные системы доставки факторов транскрипции в соматические клетки использовали первыми, однако у них есть недостаток: генетический материал ретровирусов включается в клеточный геном, а это, мягко говоря, небезопасно. 2. В настоящий момент разработаны вирусные векторы, у которых нарушена интеграция собственного генома в доставляемые клетки (например, лентивирусные векторы с дефектом интегразы или аденовирусы). 3. Самовырезающиеся векторы (технология piggyBac позволяет встраивать нужные гены в клетки без использования вирусных векторов, а при желании их можно удалить без нарушения исходной структуры ДНК). 4. Малые молекулы — методика получения ИПСК без вмешательств в геном.
Наверное, может показаться, что всё описанное выше еще довольно далеко от реальности. Но, например, совсем недавно 25-летней женщине, страдающей сахарным диабетом 1 типа, китайские ученые трансплантировали островковые клетки поджелудочной железы. β-Клетки были получены с помощью малых молекул из собственной жировой ткани женщины [52], [53]. Это позволило добиться ремиссии тяжелого течения заболевания, а по словам самой девушки, она наконец-таки может спокойно не ограничивать себя в употреблении сахара.
Использование малых молекул для перепрограммирования имеет много преимуществ. Их довольно легко синтезировать и обеспечивать доставку внутрь организма — в этом они сравнимы с обычными лекарственными препаратами. Именно поэтому у них существует потенциал использования не только для перепрограммирования in vitro , но и в качестве лекарств для стимуляции клеток пациента к восстановлению и регенерации in vivo [54]. Хотя для начала нужно понять, как не превратить все клетки организма в недифференцированные... Хочется верить, будет создана специальная форма доставки малых молекул, которая будет активироваться только при определенных условиях (например, при повреждении тканей).
Более подробно о терминах in vivo и in vitro можно узнать в статье: «In vivo — in vitro — in silico» [55].
Некоторые стволовые и прогениторные клетки могут быть мобилизованы в системный кровоток и места повреждения с помощью сигнальных механизмов, которые сейчас активно изучаются (так, например, в гематологии используется препарат «Плериксафор», который взаимодействует с рецепторами CXCR4 и CXCR7 на поверхности гемопоэтических СК и мобилизует их из костного мозга в системный кровоток). Было показано, что комплекс лигандов SDF1/CXCR4, трансформирующий фактор роста-β (TGF-β), костные морфогенетические белки (BMP), факторы роста фибробластов (FGF) инсулиноподобные факторы роста (IGF), тромбоцитарные факторы роста (PDGF) активно участвуют в мобилизации стромальных/прогениторных клеток из костного мозга в периферическую кровь. Управление сигнальными путями позволит задействовать собственный регенеративный потенциал тканей без использования трансплантированных СК [56].
Но всё же в настоящий момент сохраняются опасения возникновения онкологических заболеваний при проведении терапии с использованием СК. Это обусловлено тем, что некоторые недифференцированные и/или незрелые клетки могут сохраняться в конечных трансплантированных продуктах, также возможна остаточная активность факторов перепрограммирования, способствующих онкогенезу . Туморогенность может быть вызвана и генетическими мутациями, возникающими во время культивирования ИПСК in vitro [57].
Подробнее об онкогенезе можно узнать из нашего спецпроекта, посвященному онкологии: «От медицинской онкологии к молекулярной биологии рака» [58].
Лечение заболеваний с помощью стволовых клеток и потенциальные проблемы
Вероятно, будет гораздо проще перечислить те области медицины, где СК не пытались бы использовать. Но мы кратко попытались представить наиболее выдающиеся и, что не менее важно, реальные результаты применения СК (рис. 5).
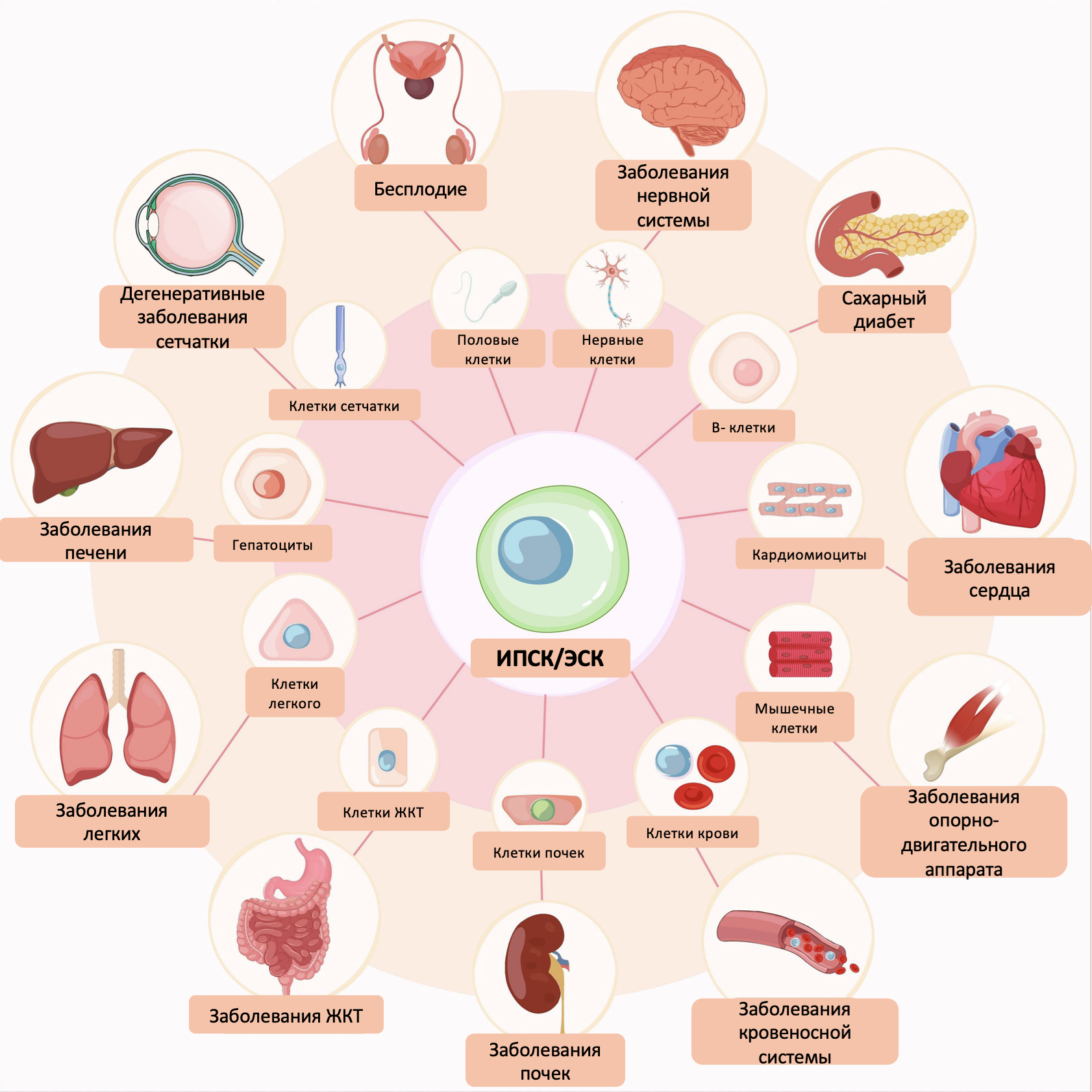
Рисунок 5. Потенциальные области применения стволовых клеток.
Применение СК изучается для лечения разнообразных заболеваний, таких как рак, сахарный диабет, нейродегенеративные и сердечно-сосудистые заболевания, болезни глаз и т.д. Все клинические испытания в основном сосредоточены на исследовании безопасности такой терапии. Попыток применения очень много (по данным на январь 2025 года, более 290 клинических испытаний только с МСК находятся в активной фазе), однако окончательно одобренных методов лечения с применением СК уже гораздо меньше (большинство исследований находится либо в зачаточном состоянии (доклиническая стадия), либо описаны серии клинических случаев применения СК).
В медицинской практике клеточные технологии пытаются использовать для:
- Непосредственно клеточной терапии (замена клеток организма, которые были повреждены или разрушены в результате травмы или болезни). СК, используемые для трансплантации, могут быть аутологичными (донором и реципиентом выступает один и тот же человек) или аллогенными (т.е. полученными от другого человека).
- Моделирования заболеваний, что способствует разработке лекарственной терапии (СК предоставляют возможность создания моделей заболеваний in vitro, которые могут ускорить разработку новых методов лечения: «Лекарство в пробирке: доклинические исследования in vitro» [64]).
- «Обучения» клеток — так были созданы CAR-T, выполняющие функцию поиска и уничтожения раковых клеток, на которую оказываются не способны клетки самого организма. Мы писали об этом подробнее в статьях «Способны ли CAR-Т-клетки уничтожить опухоль?» [65], «Как первые российские CAR-T-клетки с опухолью боролись» [66] и «Многофакторная аутентификация помогает бороться с раком» [67].
В настоящий момент проводится огромное количество клинических исследований с использованием СК для лечения болезни Паркинсона, макулодистрофии, пигментного ретинита, сердечной недостаточности, повреждения спинного мозга, дефектов хрящей, реакции «трансплантат против хозяина», иммунотерапии рака [68] и многих других заболеваний. И есть отличные новости: несколько одобренных препаратов уже применяются в разных областях медицины!
Не просто стволовые, а генно-модифицированные…
Трансплантация гемопоэтических СК [69] уже довольно долго является стандартом лечения онкогематологических и некоторых наследственных заболеваний. К тому же в последнее время активно изучается использование генной терапии в сочетании с трансплантацией аутологичных гемопоэтических СК для лечения наследственных заболеваний. Так, например, существует Skysona — препарат, позволяющий редактировать поврежденный ген в аутологичных гемопоэтических СК СD34+ у детей с адренолейкодистрофией (еще в 2022 году одобрен FDA США). А совсем недавно опубликованы впечатляющие отдаленные результаты лечения этим препаратом: через 48 месяцев общая выживаемость составила 94%, а выживаемость без серьезных симптомов — 91% [70].
Еще одним замечательным примером сочетания генных и клеточных технологий является Эксагамглоген аутотемцел (Casgevy). Препарат используется для лечения людей старше 12 лет с бета-талассемией и серповидноклеточной анемией. Обычно при тяжелом течении этих заболеваний выполняется переливание донорской крови. Но что предпринять, если это невозможно? Для этих случаев FDA как раз и был одобрен Casgevy в конце 2023 и начале 2024 годов. Дело в том, что препарат содержит генетически модифицированные с помощью технологии CRISPR/Cas9 аутологичные гемопоэтические СК, которые в организме превращаются в нормальные клетки крови.
Еще в 2016 году в Евросоюзе (ЕС) для тяжелого комбинированного иммунодефицита был официально зарегистрирован препарат Strimvelis, действие которого также основано на трансплантации отредактированных аутологичных СD34+ гемопоэтических СК.
Таким образом, мы видим, что использование гемопоэтических СК активно развивается, и их применение распространяется уже за пределы гематологии в другие области медицины.
Препараты на основе МСК
впервые появились на рынке в 2010 году, когда в Корее был одобрен препарат Queencell, представляющий собой гетерогенную смесь МСК и других типов клеток (преадипоциты, эндотелиальные клетки-предшественники, тучные клетки и фибробласты), нацеленную на лечение дефектов мягких тканей.
Терапия с использованием СК может быть эффективной и для лечения печеночной недостаточности. В одном из исследований 45 пациентов с хроническим гепатитом В и декомпенсированным циррозом печени разделили на две группы: получавшую МСК (n = 30) и контрольную (n = 15). Результаты показали значительное снижение объема асцита в группе МСК [71]. Дополнительно продолжаются клинические исследования с использованием МСК для лечения нейродегенеративных заболеваний [72]. А в 2017 году у 60 пациентов с ожогами [73] 10–25% поверхности тела терапия МСК ускоряла заживление их ран и сократила сроки госпитализации [74].
СК, конечно же, пытались применять и при сердечно-сосудистых заболеваниях. Однако многочисленные исследования показали противоречивые результаты введения СК и в основном отсутствие статистически значимых различий в исходах инфаркта миокарда, сердечной функции или других клинических результатах [75]. Но, несмотря на это, еще с 2011 года в Корее существует препарат на основе МСК Cellgram-AMI, применение которого у пациентов с острым инфарктом миокарда должно ускорять и улучшать восстановление.
Мы уже обсуждали, что кишечник и печень имеют большой регенеративный потенциал, однако его аутоиммунные и хронические воспалительные заболевания представляют огромную проблему современной медицины. Недавний систематический обзор 18 исследований показал в 11 из них снижение индекса активности болезни Крона при использовании СК по сравнению с контрольной группой [70]. Также довольно интересно, что именно препарат для лечения осложнений болезни Крона, Darvadstrocel, стал первым продуктом на основе МСК, одобренным в ЕС. Однако в конце прошлого года Takeda опубликовала результаты исследования III фазы ADMIRE-CD II, которое изучало его эффективность в лечении анальных фистул при Болезни Крона, и она, к сожалению, оказалась незначимой.
К тому же совсем недавно, в декабре 2024 года, FDA впервые (!) одобрило препарат на основе МСК — им стало лекарство Remestemcel-L-rknd (Ryoncil) для лечения реакции «трансплантат против хозяина» у детей от двух месяцев (о перипетиях его разработки подробнее рассказывается в нашем обзоре за вторую половину 2024 года [76]).
Клеточные технологии — не только СК
Одной из самых ранних разработок методов клеточной инженерии является имплантация аутологичных хондроцитов для регенерации суставного хряща. Хондроциты берутся из областей с низкой нагрузкой (например, с хрящевой поверхности надколенника), а затем их трансплантируют в поврежденные суставные поверхности [77]. Например, препарат Spherox содержит сферические агрегаты хондроцитов, которые были получены из собственных тканей пациента, и используется для восстановления дефектов коленного хряща. Этот же препарат под названием «Изитенс» компании «Генериум» впервые зарегистрирован в России в 2023 году. Другим направлением в ортопедии является применение хондроцитов, полученных в результате перепрограммирования ЭСК или МСК [78]. В настоящий момент эффективность препарата для лечения дефектов хрящевой ткани суставов на основе аллогенных МСК (Cartistem) изучается в исследовании III фазы в Японии.
На сегодняшний день накоплено большое количество данных применения различных типов СК для лечения сахарного диабета 1 типа и различных онкологических заболеваний. У нас есть отдельные статьи, посвященные трансплантации островковых клеток поджелудочной железы [79] и клеточной терапии злокачественных опухолей [80]. В 2023 году впервые в истории лечения сахарного диабета 1 типа FDA был одобрен препарат Donislecel (Lantidra), который представляет собой аллогенные островковые клетки от трупных доноров. Замечательной новостью также является и то, что в феврале прошлого года официально появился новый препарат Lifileucel (Amtagvi) для лечения меланомы — это первое лечение солидных опухолей на основе аутологичных лимфоцитов, инфильтрирующих ткань опухоли.
ЭСК — на благо другим людям?
Гораздо бóльшие надежды возлагаются на СК в лечении дегенеративных заболеваний сетчатки. Так, донорские ЭСК в сочетании с иммуносупрессией использовались у 18 пациентов с возрастной макулярной дегенерацией или макулярной дистрофией Штаргардта. Улучшение зрения произошло у 10 из 18 человек (56%), а в течение 22 месяцев не было выявлено никаких признаков онкологических процессов, отторжения, серьезной локальной или системной токсичности[81]. В то же время активно предпринимаются попытки применения донорских СК для регенерации роговицы в офтальмологической практике В 2015 году в ЕС был одобрен препарат Holoclar — это стволовые клетки роговицы, которые берутся из ее лимбальной области и применяются для лечения ожогов глаза [82].
Около года назад компания BlueRock Therapeutics опубликовала данные предварительных результатов 12 пациентов с болезнью Паркинсона, которые получали лечение полученными из человеческих ЭСК клетками-предшественниками дофаминергических нейронов. Два года спустя лечение оказалось безопасным и довольно эффективным. Не менее примечательными являются попытки лечения эпилепсии. В ходе клинического исследования, проведенного биотехнологической компанией Neurona Therapeutics, хирурги пересадили интернейроны, полученные из ЭСК, в мозг десяти человек с неконтролируемой формой эпилепсии. Через год после трансплантации частота тяжелых эпиприступов у первых двух участников снизилась почти до нуля, и этот эффект сохранялся в течение нескольких лет. У большинства других участников наблюдалось выраженное снижение частоты приступов, а существенных побочных эффектов не отмечалось.
Подводя итог, можно сказать, что, несмотря на доказанную эффективность СК в некоторых областях, одобренных препаратов всё еще мало, а провалы в клинических исследованиях, наоборот, исчисляются десятками. Посмотрим на проблемы, с которыми приходится сталкиваться при попытках применения СК в медицине.
Почему стволовые клетки еще не стали панацеей?
По данным ClinicalTrials.gov — ресурса, где обязательно регистрируются все проводимые в США клинические испытания, — статус многих исследований с СК неизвестен, либо они завершились без публикации полученных результатов... Почему же, несмотря на очевидную эффективность, СК остаются скорее экспериментальным методом лечения? К сожалению, в этой области имеется целый ряд нерешенных проблем:
- Всё еще затруднено создание определенных типов клеток из СК. Направленная дифференциация — сложный процесс, который не до конца понятен. На него могут влиять многие факторы (условия культивирования клеток, цитокины и ряд других). Таким образом, необходимы дополнительные исследования для повышения контроля направления и качества дифференцировки СК.
- Остро стоит вопрос о потенциальной онкогенности применяемых СК, поскольку было показано, что они могут формировать тератомы (опухоли, содержащие клетки всех трех эмбриональных ростков). Развитие гематологических злокачественных новообразований после трансплантации модифицированных гемопоэтических СК также является серьезной проблемой [83]. Необходимо больше исследований, подтверждающих безопасность трансплантированных клеток, а также совершенствование специальных протоколов созревания и доставки СК.
- Использование ЭСК порождает этические споры, так как для их получения используются человеческие эмбрионы. ИПСК — возможное решение этой проблемы как альтернативного источника плюрипотентных клеток.
- В связи с большим разнообразием технологий и видов СК до сих пор остро стоит проблема безопасности терапии в клинических исследованиях.
- Бурное развитие регенеративной медицины создает возможности мошенникам, предлагающим терапию на основе СК. Дело в том, что по современным правилам клетки, отобранные у человека и введенные ему обратно без значительных манипуляций (таких как генно-инженерные), не считаются лекарственным препаратом, и требования контроля качества, доказательств эффективности и безопасности к ним намного меньше. Этим пользуются недобросовестные клиники, рекламирующие услуги по применению стволовых клеток для омоложения, косметологии и лечения различных заболеваний.
- В настоящий момент также имеются проблемы сохранения жизнеспособности и способов доставки СК. Активно ведутся разработки в этих областях. Например, создана система, которая основана на смешивании СК с наночастицами, которые могут действовать как наноносители для СК или белков. Наночастицы также имеют небольшой размер и низкую токсичность, что дополнительно ограничивает возможные иммуногенные или опухолевые реакции [84].
- При применении клеток в качестве лекарственных средств важная проблема — обеспечение контроля качества при производстве, хранении, транспортировке и применении клеточных продуктов. Этому аспекту посвящена статья на «Биомолекуле»: «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [85].
- Выживаемость СК после трансплантации зависит от иммунной системы хозяина, поскольку иммунный ответ хозяина на аллогенные клетки напрямую способствует отторжению трансплантата. Эта проблема решаема при использовании иСК.
Но трудности — это лишь стимул к дальнейшему развитию и совершенствованию! В настоящий момент инициировано более 100 клинических испытаний с СК для лечения разнообразных заболеваний.
Смотрим в будущее с надеждой
Клеточная терапия — это новый терапевтический подход, одним из главных направлений которого является применение уникальных самообновляющихся и универсальных стволовых клеток для регенерации поврежденных клеток и тканей в организме человека или замены этих клеток новыми, здоровыми и полностью функциональными. Количество проводимых клинических исследований с применением СК впечатляет и увеличивается с каждым годом. Это еще раз подчеркивает, что данное направление имеет огромный потенциал. Однако врачам и ученым еще предстоит решить ряд проблем, чтобы внедрить СК в повседневную практику.
Литература
- 12 методов в картинках: клеточные технологии;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Тканевая инженерия и что она может предложить сегодня;
- Siiri E. Iismaa, Xenia Kaidonis, Amy M. Nicks, Nikolay Bogush, Kazu Kikuchi, et. al.. (2018). Comparative regenerative mechanisms across different mammalian tissues. npj Regen Med. 3;
- Ствол и ветки: стволовые клетки;
- Andrey Elchaninov, Gennady Sukhikh, Timur Fatkhudinov. (2021). Evolution of Regeneration in Animals: A Tangled Story. Front. Ecol. Evol.. 9;
- Samuel E. Senyo, Matthew L. Steinhauser, Christie L. Pizzimenti, Vicky K. Yang, Lei Cai, et. al.. (2013). Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493, 433-436;
- Olaf Bergmann, Sofia Zdunek, Anastasia Felker, Mehran Salehpour, Kanar Alkass, et. al.. (2015). Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 161, 1566-1575;
- Z. Mallat, P. Fornes, R. Costagliola, B. Esposito, J. Belmin, et. al.. (2001). Age and Gender Effects on Cardiomyocyte Apoptosis in the Normal Human Heart. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 56, M719-M723;
- Bernhard J. Haubner, Johanna Schneider, Ulrich Schweigmann, Thomas Schuetz, Wolfgang Dichtl, et. al.. (2016). Functional Recovery of a Human Neonatal Heart After Severe Myocardial Infarction. Circulation Research. 118, 216-221;
- Dongwei Liu, Fei Cheng, Shaokang Pan, Zhangsuo Liu. (2020). Stem cells: a potential treatment option for kidney diseases. Stem Cell Res Ther. 11;
- Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня;
- Yamanaka, N. et al. (1993). Dynamics of normal and injured human liver regeneration after hepatectomy as assessed on the basis of computed tomography and liver function. Hepatology. 18, 79–85;
- Stuart J Forbes, Nadia Rosenthal. (2014). Preparing the ground for tissue regeneration: from mechanism to therapy. Nat Med. 20, 857-869;
- Eugenio Sangiorgi, Mario R. Capecchi. (2009). Bmi1 lineage tracing identifies a self-renewing pancreatic acinar cell subpopulation capable of maintaining pancreatic organ homeostasis. Proc. Natl. Acad. Sci. U.S.A.. 106, 7101-7106;
- Monica Teta, Simon Y. Long, Lynn M. Wartschow, Matthew M. Rankin, Jake A. Kushner. (2005). Very Slow Turnover of β-Cells in Aged Adult Mice. Diabetes. 54, 2557-2567;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Stefan Wirtz, Vanessa Popp, Markus Kindermann, Katharina Gerlach, Benno Weigmann, et. al.. (2017). Chemically induced mouse models of acute and chronic intestinal inflammation. Nat Protoc. 12, 1295-1309;
- Olaf Bergmann, Kirsty L. Spalding, Jonas Frisén. (2015). Adult Neurogenesis in Humans. Cold Spring Harb Perspect Biol. 7, a018994;
- Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить;
- Dong Sun. (2014). The potential of endogenous neurogenesis for brain repair and regeneration following traumatic brain injury. Neural Regen Res. 9, 688;
- Sheng Li. (2017). Spasticity, Motor Recovery, and Neural Plasticity after Stroke. Front. Neurol.. 8;
- Yousef, H., Alhajj, M., Fakoya, A. O., Sharma, S. Anatomy, Skin (Integument), Epidermis. StatPearls Publishing, 2024;
- Ya-Chieh Hsu, Lishi Li, Elaine Fuchs. (2014). Emerging interactions between skin stem cells and their niches. Nat Med. 20, 847-856;
- Регенерация на кончиках пальцев;
- Иглистые мыши и их уникальные способности к регенерации;
- Darrell N Kotton, Edward E Morrisey. (2014). Lung regeneration: mechanisms, applications and emerging stem cell populations. Nat Med. 20, 822-832;
- M. Camila Melo-Narváez, John Stegmayr, Darcy E. Wagner, Mareike Lehmann. (2020). Lung regeneration: implications of the diseased niche and ageing. Eur Respir Rev. 29, 200222;
- Emérito Carlos Rodríguez-Merchán. (2022). Molecular Mechanisms of Cartilage Repair and Their Possible Clinical Uses: A Review of Recent Developments. IJMS. 23, 14272;
- Judy E. Anderson. (2022). Key concepts in muscle regeneration: muscle “cellular ecology” integrates a gestalt of cellular cross-talk, motility, and activity to remodel structure and restore function. Eur J Appl Physiol. 122, 273-300;
- Xulin Hu, Haoming Wu, Xin Yong, Yao Wang, Shuhao Yang, et. al.. (2023). Cyclical endometrial repair and regeneration: Molecular mechanisms, diseases, and therapeutic interventions. MedComm. 4;
- Hamdy Y. Ismail, Shaymaa Hussein, Nora A. Shaker, Hamdy Rizk, Y. R. Wally. (2023). Stem Cell Treatment Trials for Regeneration of Testicular Tissue in Laboratory Animals. Reprod. Sci.. 30, 1770-1781;
- Alessandro Ilacqua, Davide Francomano, Antonio Aversa. (2018). The Physiology of the Testis. Endocrinology. 455-491;
- Alisha M. Truman, Jonathan L. Tilly, Dori C. Woods. (2017). Ovarian regeneration: The potential for stem cell contribution in the postnatal ovary to sustained endocrine function. Molecular and Cellular Endocrinology. 445, 74-84;
- Duc M. Hoang, Phuong T. Pham, Trung Q. Bach, Anh T. L. Ngo, Quyen T. Nguyen, et. al.. (2022). Stem cell-based therapy for human diseases. Sig Transduct Target Ther. 7;
- Jipeng Wang, Gang Deng, Shuyi Wang, Shuang Li, Peng Song, et. al.. (2024). Enhancing regenerative medicine: the crucial role of stem cell therapy. Front. Neurosci.. 18;
- Laperrousaz B. (2015). Role of the microenvironment in maintenance and resistance of leukemic stem cells in Chronic Myelogenous Leukemia. BMP pathway and mechanical forces;
- Aayush A. Shah, Firdos Alam Khan. (2021). Types and Classification of Stem Cells. Stem Cell Biology and Regenerative Medicine. 25-49;
- Такие разные стволовые клетки;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- K. Esfahani, L. Roudaia, N. Buhlaiga, S.V. Del Rincon, N. Papneja, W.H. Miller. (2020). A Review of Cancer Immunotherapy: From the Past, to the Present, to the Future. Current Oncology. 27, 87-97;
- Antoine de Morree, Thomas A. Rando. (2023). Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24, 334-354;
- Mark F. Pittenger, Dennis E. Discher, Bruno M. Péault, Donald G. Phinney, Joshua M. Hare, Arnold I. Caplan. (2019). Mesenchymal stem cell perspective: cell biology to clinical progress. npj Regen Med. 4;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Была клетка простая, стала стволовая;
- Matthias Stadtfeld, Konrad Hochedlinger. (2010). Induced pluripotency: history, mechanisms, and applications. Genes Dev.. 24, 2239-2263;
- Mohammad Mousaei Ghasroldasht, Jin Seok, Hang-Soo Park, Farzana Begum Liakath Ali, Ayman Al-Hendy. (2022). Stem Cell Therapy: From Idea to Clinical Practice. IJMS. 23, 2850;
- Jonas Cerneckis, Hongxia Cai, Yanhong Shi. (2024). Induced pluripotent stem cells (iPSCs): molecular mechanisms of induction and applications. Sig Transduct Target Ther. 9;
- Anna Knyazer, Gabriela Bunu, Dmitri Toren, Teodora Bucaciuc Mracica, Yael Segev, et. al.. (2021). Small molecules for cell reprogramming: a systems biology analysis. Aging. 13, 25739-25762;
- Wojciech Zakrzewski, Maciej Dobrzyński, Maria Szymonowicz, Zbigniew Rybak. (2019). Stem cells: past, present, and future. Stem Cell Res Ther. 10;
- Gele Liu, Brian T. David, Matthew Trawczynski, Richard G. Fessler. (2020). Advances in Pluripotent Stem Cells: History, Mechanisms, Technologies, and Applications. Stem Cell Rev and Rep. 16, 3-32;
- Shusen Wang, Yuanyuan Du, Boya Zhang, Gaofan Meng, Zewen Liu, et. al.. (2024). Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patient. Cell. 187, 6152-6164.e18;
- Yuanyuan Du, Zhen Liang, Shusen Wang, Dong Sun, Xiaofeng Wang, et. al.. (2022). Human pluripotent stem-cell-derived islets ameliorate diabetes in non-human primates. Nat Med. 28, 272-282;
- Abdur Rehman, Israr Fatima, Fatima Noor, Muhammad Qasim, Peng Wang, et. al.. (2024). Role of small molecules as drug candidates for reprogramming somatic cells into induced pluripotent stem cells: A comprehensive review. Computers in Biology and Medicine. 177, 108661;
- In vivo — in vitro — in silico;
- Cierra A. Clark, Takeshi Oichi, Joshua M. Abzug, Satoru Otsuru. (2022). In Situ Targeting of Stem and Progenitor Cells in Native Tissues. Orthobiologics. 393-402;
- Shinya Yamanaka. (2020). Pluripotent Stem Cell-Based Cell Therapy—Promise and Challenges. Cell Stem Cell. 27, 523-531;
- От медицинской онкологии к молекулярной биологии рака;
- Аполихина И.А., Саидова А.С., Тетерина Т.А. (2019). Эффективность применения локальной цитокинотерапии в комплексном лечении пациенток с хроническим циститом. Акушерство и гинекология. 12, 167–172;
- Kulchavenya E.V. Kulchavenya, Treivish L.S. Treivish, Telina E.V. Telina, Kholtobin D.P. Kholtobin, Brizhatyuk E.V. Brizhatyuk, et. al.. (2024). Postcoital cystitis in menopause. Urologiia. 3_2024, 21-27;
- E.V. Kulchavenya Kulchavenya, A.I. Neymark Neymark, A.Yu. Tcukanov Tcukanov, P.S. Plugin Plugin, A.B. Neymark Neymark, et. al.. (2022). Combined therapy of patients with recurrent cystitis using a complex of natural antimicrobial peptides and cytokines: first results. Urologiia. 6_2022, 47-55;
- Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. (2022). Роль иммунотерапии в комплексном лечении женщин с хроническим циститом. Русский медицинский журнал;
- Ali Pirsadeghi, Negar Namakkoobi, Mahtab Sharifzadeh Behzadi, Hanieh Pourzinolabedin, Fatemeh Askari, et. al.. (2024). Therapeutic approaches of cell therapy based on stem cells and terminally differentiated cells: Potential and effectiveness. Cells & Development. 177, 203904;
- Лекарство в пробирке: доклинические исследования in vitro;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Как первые российские CAR-T-клетки с опухолью боролись;
- Многофакторная аутентификация помогает бороться с раком;
- Jennifer Yejean Kim, Yoojun Nam, Yeri Alice Rim, Ji Hyeon Ju. (2022). Review of the Current Trends in Clinical Trials Involving Induced Pluripotent Stem Cells. Stem Cell Rev and Rep. 18, 142-154;
- Генная терапия гемопоэтическими стволовыми клетками;
- Florian Eichler, Christine N. Duncan, Patricia L. Musolino, Troy C. Lund, Ashish O. Gupta, et. al.. (2024). Lentiviral Gene Therapy for Cerebral Adrenoleukodystrophy. N Engl J Med. 391, 1302-1312;
- Zheng Zhang, Hu Lin, Ming Shi, Ruonan Xu, Junliang Fu, et. al.. (2012). Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients. J of Gastro and Hepatol. 27, 112-120;
- Ramyar Rahimi Darehbagh, Seyedeh Asrin Seyedoshohadaei, Rojin Ramezani, Nima Rezaei. (2024). Stem cell therapies for neurological disorders: current progress, challenges, and future perspectives. Eur J Med Res. 29;
- Обуздать воспаление: мезенхимальные стволовые клетки в терапии ожогов и обморожений;
- Abo-Elkheir W. et al. (2017). Role of cord blood and bone marrow mesenchymal stem cells in recent deep burn: a case-control prospective study. Am J Stem Cells. 6, 23–35;
- Mariann Gyöngyösi, Wojciech Wojakowski, Eliano P. Navarese, Lemuel À. Moye. (2016). Meta-Analyses of Human Cell-Based Cardiac Regeneration Therapies. Circulation Research. 118, 1254-1263;
- Новости биофармы во второй половине 2024 года: клеточная терапия саркомы, новейшее лекарство от шизофрении, опухолевый атлас и многое другое;
- Omar M Ismail, Umar N Said, Omar M El-Omar. (2022). Adult Stem Cells for Cartilage Regeneration. Cureus;
- Pengzhen Wang, Shaoheng Zhang, Qingqi Meng, Pingping Zhu, Wei Yuan. (2022). Treatment and application of stem cells from different sources for cartilage injury: a literature review. Ann Transl Med. 10, 610-610;
- Трансплантация островков поджелудочной железы: как, кому и почему не всем?;
- Клетки, которые лечат людей;
- Steven D Schwartz, Carl D Regillo, Byron L Lam, Dean Eliott, Philip J Rosenfeld, et. al.. (2015). Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. The Lancet. 385, 509-516;
- Shiding Li, Hao Sun, Liangbo Chen, Yao Fu. (2024). Targeting limbal epithelial stem cells: master conductors of corneal epithelial regeneration from the bench to multilevel theranostics. J Transl Med. 22;
- Catriona H.M. Jamieson, Irving L. Weissman. (2023). Stem-Cell Aging and Pathways to Precancer Evolution. N Engl J Med. 389, 1310-1319;
- Ingrid Safina, Mildred C. Embree. (2022). Biomaterials for recruiting and activating endogenous stem cells in situ tissue regeneration. Acta Biomaterialia. 143, 26-38;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов.







