Конструкторское бюро белков
15 марта 2021
Конструкторское бюро белков
- 3907
- 0
- 19
Дизайн белков — это как игра в конструктор LEGO: создать можно всё, что придет в голову
рисунок Васили Сулеймановой
-
Авторы
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Создание новых белков с заранее выбранной функцией? Что? Да!!! Нужна вакцина? Дизайним белок! Нужно вылечить рак? Дизайним белок! Звучит очень заманчиво, но реально ли это? Rosetta — программа, разработанная в Институте белкового дизайна под руководством Дэвида Бейкера, дает утвердительный ответ на этот вопрос. С ее помощью ученым удалось справиться с целиакией, создать лекарство широкого спектра от вируса гриппа и научить иммунные клетки находить и убивать раковые. Несколько компаний сейчас занимаются выводом этих разработок на рынок. В этой статье мы разберемся, как работает Rosetta и какие проблемы белковый дизайн позволяет решать уже сегодня.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Наверняка многие из вас в детстве играли с конструктором LEGO. Лично я проводил вечера напролет, собирая различные модели. Правила сборки очень простые: у каждой детали есть сторона с цилиндрическими выпуклостями и есть сторона с полостями. Чтобы соединить две фигурки, нужно вставить цилиндр одной в полость другой. Каждая деталь имеет несколько цилиндров и полостей, что позволяет собирать разные конструкции. Из 1000 деталей можно сделать машину, катер, дом — в общем, всё, что приходит в голову.
У этой статьи два автора: я, Павел Буслаев, писал текст, а Василя Сулейманова подготовила наглядные иллюстрации.
Белки в чём-то напоминают конструктор LEGO. Это длинные линейные нити аминокислот — основных деталей конструктора (рис. 1). В этом и главное отличие от LEGO: там детали никак не связаны друг с другом. Аминокислоты взаимодействуют друг с другом и образуют устойчивые структуры — вторичные элементы (α-спирали и β-листы), которые соединяются относительно гибкими петлями. Эти стабильные блоки также взаимодействуют друг с другом и упаковываются в трехмерную структуру (рис. 1). Пространственное строение белков изучает структурная биология [1], а процесс сворачивания белка из полипептидной нити в устойчивую конформацию называется фолдингом [2].
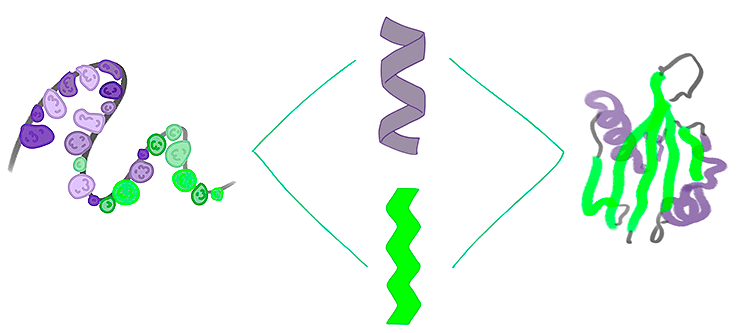
Рисунок 1. Фолдинг белка. Аминокислоты — строительные кирпичи белков. Они соединяются друг с другом за счет ковалентных связей. При этом у аминокислоты не может быть больше двух соседей (белки — полимеры линейные). В итоге образуется длинная полипептидная нить (слева), которая за счет слабых взаимодействий [3] обретает определенную форму: сначала образуются элементы вторичной структуры (α-спирали и β-листы; в центре), которые затем объединяются в трехмерную третичную упаковку (справа). Упорядоченные белки могут соединяться друг с другом, образуя сложные комплексы — четвертичную упаковку. Процесс обретения трехмерной структуры полипептидной нитью называется фолдингом [2].
рисунок Васили Сулеймановой
Фолдинг белка контролируется по большей части слабыми взаимодействиями: водородными и ионными связями, силой Ван-дер-Ваальса и прочими [3]. В сильно упрощенном представлении каждая новая слабая связь уменьшает энергию белка (см. врезку «Энергия и фолдинг»). В развернутом состоянии таких взаимодействий практически нет, а в нативной структуре их число максимально. Значит, третичная структура находится в энергетическом минимуме и является устойчивой.
Структура белка определяет его функцию. А значит, если мы разберемся с правилами сборки аминокислотного конструктора, то научимся создавать белки с любыми функциями — даже такими, которые не встречаются в природе. Это открывает удивительные возможности: диагностика и борьба с заболеваниями, эффективное и экологичное производство. Цели действительно захватывающие!
Ученые со всего мира потратили много времени и ресурсов в попыткак понять, как соединить детали (аминокислоты) белкового LEGO. К настоящему моменту разработан ряд экспериментальных и вычислительных методов, позволяющих изучать, управлять и создавать новые белки. Подробности о биологических задачах, которые решают за экранами мониторов, вы можете узнать в статье «Биомолекулы» «12 методов в картинках: “сухая” биология» [8]. Грубо говоря, компьютерные программы пробуют исполнять роль инструкций к аминокислотному конструктору, а эксперименты проверяют, насколько эти руководства пользования хороши, и генерируют новые данные для улучшения «сухих» методов.
В этом тексте мы обсудим одну из таких инструкций. Ее на протяжении 25 лет создавал коллектив под руководством Дэвида Бейкера (рис. 3). Ученые разработали программу Rosetta специально для дизайна белков. Она основана на сложных математических алгоритмах и опирается на экспериментальные данные. С ее помощью исследователи создали белки, выполняющие различные функции, и внесли существенный вклад в наше понимание фолдинга. «Биомолекула» неоднократно писала об успехах Бейкера [5], [9], [10], однако за последние годы было сделано еще несколько выдающихся работ. Далее мы постараемся систематизировать результаты, полученные в Институте белкового дизайна: сначала разберем основы, заложенные в программу Rosetta, а затем обсудим самые успешные случаи ее использования.
Rosetta
В каждом наборе LEGO есть опция для «новичков»: собрать по инструкции. Например, можно смастерить такой корабль. Главное не потерять детали и соблюдать последовательность сборки. В какой-то момент инструкция, естественно, теряется, но собрать модель всё равно реально — необходимо вспомнить, что было написано в руководстве. Собранный корабль — это еще не конец истории. Можно повесить паруса другого цвета, доставить пару пушек, приделать мотор — проапгрейдить модель, не сильно отходя от оригинала.
Подобные задачи решаются и для белков. Аминокислотная последовательность белка однозначно определяет его форму. Как именно? Знает только природа. Попытка предсказать структуру из последовательности — это и есть сборка без инструкции.
Готовый белок можно улучшить. Для этого есть множество способов. Во врезке «Энергия и фолдинг» мы говорили, что свободная энергия состоит из двух частей: энтальпийной и энтропийной. Первое слагаемое не меняется, а второе падает с увеличением температуры. Значит, чем теплее белок, тем менее «крутой» будет энергетическая воронка, а при определенной температуре белок вообще потеряет свою способность сворачиваться. Один (но далеко не единственный!) из способов улучшения белка — сделать его более термостабильным, то есть заставить работать при более высоких показаниях термометра.
Rosetta позволяет и предсказать структуру белка, и улучшить его. Именно на примере двух этих задач мы познакомимся с базовыми алгоритмами программы Бейкера.
Предсказание структуры
Задача предсказания структуры белка занимает ученых уже давно. Недавно за эту проблему — и весьма успешно! — взялся даже Google с алгоритмом alphaFold. «Биомолекула» писала об успехах в этой области в статьях «Торжество компьютерных методов: предсказание строения белков» [5] и «AlphaFold: нейросеть для предсказания структуры белков от британских ученых» [11].
Есть два основных способа получить структуру белка на компьютере: по гомологии и «из первых принципов» [5]. Первый подход основан на эмпирическом знании: похожие аминокислотные последовательности (идентичность >30%) сворачиваются в близкие конформации (однако бывают и исключения [12], [13]). Мы выбираем шаблон — белок с похожей последовательностью, на него «натягиваем» аминокислоты моделируемой молекулы и релаксируем получившуюся структуру. Моделирование «из первых принципов» (de novo) в явном виде не использует информацию о других белках. По сути, мы решаем задачу оптимизации: сопоставляем белку функцию, которая имитирует его энергию (см. врезку «Энергия и фолдинг»), и минимизируем ее. Подробности об этих методах вы можете найти в статье «Торжество компьютерных методов: предсказание структуры белков» [5].
В проблеме предсказания трехмерной упаковки de novo есть две большие задачи:
- Необходимо перебрать большое количество различных конформаций. Рассмотрим последовательность из ста аминокислот. Предположим, что угол между каждыми тремя последовательными аминокислотами может принимать одно из десяти значений — это даст уже 1098 вариантов упаковки! В реальности же эти углы непрерывны, а есть еще и другие степени свободы для каждой аминокислоты. Даже если перебирать упаковки со скоростью 1012 вариантов в секунду, то нам потребуется 1086 секунд, чтобы найти нативную упаковку белка. Это на 70 порядков (!!!) превышает возраст вселенной. При этом в природе белки обретают правильную форму гораздо быстрее, в среднем за несколько миллисекунд. Эта несостыковка между ожидаемым и реальным временем фолдинга называется парадоксом Левинталя. Гипотеза энергетической воронки, которую мы обсуждали во врезке «Энергия и фолдинг», решает этот парадокс: белок постепенно сваливается в воронку и отсекает огромное число «невыгодных» конформаций, а значит перебирать нужно всё меньше вариантов, и они всё ближе к правильному. Компьютерные алгоритмы предсказания структуры должны работать похожим образом: быстро перебирать упаковки, причем желательно только те, которые похожи на нативную.
- Необходимы правила сравнения упаковок. Чтобы перебирать только похожие на нативную конформации, нужно уметь их выбирать. Мы обсуждали во врезке «Энергия и фолдинг», что белки сворачиваются в структуру с наименьшей энергией. Компьютерные методы вычисляют функцию, которая пытается эту энергию оценивать: зная ее значение для двух упаковок белка, мы надеемся, что состояние с меньшим значением будет обладать и в природе меньшей энергией. Однако ни одна функция не воспроизводит энергию идеально, и вряд ли в ближайшем будущем воспроизведет: правила взаимодействия больших групп атомов слишком сложны и имеют квантовую природу. Все алгоритмы перебора конформаций используют функцию энергии для поиска близких к нативной упаковок.
В структурной биологии эти задачи всегда идут рука об руку. В экспериментах мы не видим, как непосредственно упакованы аминокислоты. Мы пытаемся найти форму белка, которая объясняла бы результаты наших измерений. Например, в рентгеноструктурном анализе мы светим мощным источником рентгеновских лучей на кристалл белка и видим сложную дифракционную картину. Она соответствует нативной структуре, а значит, состоянию с минимальной энергией. Мы рассчитываем паттерн дифракции для модели белка и сравниваем его с полученным экспериментально . Мы постепенно меняем модель, до тех пор, пока вычисления и эксперимент не совпадут. По сути, мы перебираем различные конформации белка, а сравнение дифракционных картин служит для нас мерой оценки энергии. Подробности о рентгеноструктурном анализе вы можете найти в статье «Биомолекулы»: «12 методов в картинках: структурная биология» [1].
Действительность немного сложнее: тут применяют обратное преобразование Фурье к картине дифракции и вычисляют распределение электронной плотности. Для этого расчета необходима модельная структура. Затем полученные плотности сравнивают с моделью, меняя ее там, где есть сильные расхождения. Считается, что нативная конформация найдена, если использованная структура вписывается в получившиеся плотности. Эта процедура называется молекулярным замещением и отлично объяснена здесь.
В компьютерных методах мы уже не так явно опираемся на эксперимент. Мы моделируем поведение белка, используя функцию оценки энергии и математические алгоритмы для ее минимизации. Например, в молекулярной динамике используют эмпирические силовые поля. С их помощью для каждого атома вычисляют действующую на него силу и, решая уравнения Ньютона, рассчитывают зависимость его положения от времени. Во время моделирования энергия системы будет уменьшаться, а значит, мы будем приближаться к оптимальной структуре.
При разработке функции энергии экспериментальные данные, естественно, используют. Но дальше на измерения уже не опираются — обход конформаций полностью определяется оценкой энергии.
Метод молекулярной динамики получил очень широкое распространение. В 2013 году Мартин Карплус, Майкл Левитт и Арье Варшель получили за его разработку Нобелевскую премию [14], [15]. «Биомолекула» также публиковала материал об этом методе: «Молекулярная динамика биомолекул. Часть I. История полувековой давности» [4]. При помощи такого моделирования даже удалось свернуть короткие белки [16], но в целом метод слишком ресурсозатратен, что ограничивает возможности его использования для предсказания структур.
Компьютерные методы, которые фокусируются на поиске оптимальных упаковок, моделируют белок иначе. «Биомолекула» рассказывала об алгоритмах, лежащих в основе этих подходов, и о результатах их применения в публикациях «Торжество компьютерных методов: предсказание строения белков» [5], «Новые успехи в предсказании пространственной структуры белков» [10] и «12 методов в картинках: «сухая» биология» [8]. Rosetta — созданная Бейкером программа для дизайна белков — в этих работах также упоминается. В этом же тексте мы уделим гораздо больше внимания заложенным в программу алгоритмам.
Основной алгоритм
Мы упоминали во вставке «Энергия и фолдинг», что сворачивание белка — это случайный процесс, который, однако, всегда приводит к одному и тому же результату. То есть, если мы возьмем две идентичные развернутые нити аминокислот, то они постепенно приобретут одинаковую трехмерную упаковку, хотя и переберут совершенно разные наборы конформаций. Rosetta поступает похожим образом: она запускает множество независимых случайных имитаций свертки белка (рис. 4) [17]. Результат такого расчета — набор структур, из которых алгоритм выбирает одну — по его мнению, наиболее похожую на нативную (рис. 4).
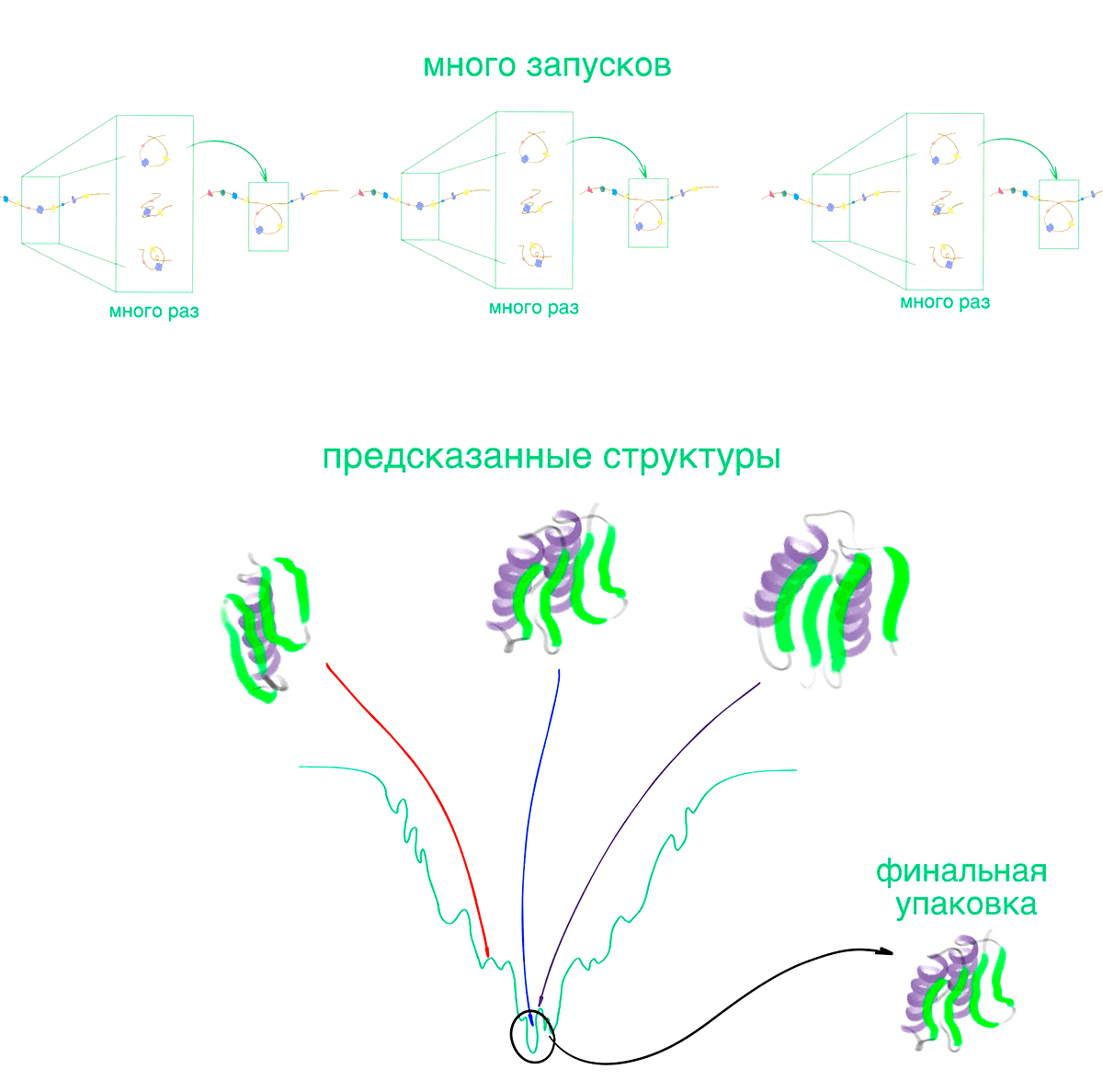
Рисунок 4. Алгоритм Rosetta. Программа запускает одновременно несколько имитаций (подробности в разделе «Моделирование фолдинга»), в результате которых получается набор структур. В идеале они все получатся одинаковыми, но в реальности так никогда не бывает: из-за случайного характера сборки, все финальные конформации немного (или не немного) различаются. Некоторые запуски приведут к структурам, сильно отличающимся от большинства. При этом рассчитанная для таких упаковок энергия может оказаться очень низкой из-за неидеальности оценки.
Каждое моделирование, по задумке ученых из Института белкового дизайна, воспроизводит фолдинг. А значит, вероятность того, что только одна сборка из многих привела к похожей на нативную конформацию, очень мала. И функция энергии, и отдельное моделирование ошибаются. Но за счет одновременного запуска множества независимых расчетов, Rosetta позволяет эти ошибки увидеть.
Конформации из полученного набора с близкими структурами и значениями энергии объединяются в группы. Если в кластере мало представителей — он отбрасывается. Среди оставшихся выбирают один с наименьшей средней энергией: нативная упаковка, скорее всего, в нем. Результатом работы Rosetta может быть любая структура из финальной группы — они все похожи друг на друга.
рисунок Васили Сулеймановой по [17]
Мы обсудили, как глобально работает Rosetta — запуск большого числа независимых моделирований и кластеризация конформаций с низкой энергией. Теперь пришло время разобраться с тем, какие алгоритмы стоят за отдельным расчетом сборки и как оценивается функция энергии.
Моделирование фолдинга
Каждый расчет сворачивания белка происходит в два этапа: сначала Rosetta ищет глобальную форму белка, а затем подбирает локальную ориентацию каждой аминокислоты. Оба раза используют вариацию метода Монте-Карло для минимизации энергии. Алгоритм последовательно повторяет одинаковые действия до тех пор, пока структура белка не перестанет меняться.
На каждом шаге программа предлагает изменить конформацию и принимает решение согласиться на обновление или нет. Этот выбор основан на сравнении энергии старой и новой структур. Если энергия уменьшается, то мы принимаем изменение, так как считаем, что такой шаг приближает нас к правильному ответу. Если же энергия наоборот увеличивается, то мы поступаем хитро.
Давайте теперь разберемся, какие изменения структуры происходят во время шага Монте-Карло при глобальной и локальной оптимизациях.
Глобальная оптимизация
Поиск примерной упаковки основывается на исследованиях, ставших основой опубликованного Бейкером в 1996 году обзора [18]. К тому моменту в базе данных PDB уже было собрано множество структур, и ученые изучали их вдоль и поперек, пытаясь разгадать связь между последовательностью белка и его формой.
Было известно, что при замене нескольких аминокислот упаковка практически не изменяется (именно на этом факте основано моделирование по гомологии [1], [5]). Ученые предполагали, что это эмпирическое правило переносится и на короткие фрагменты — участки длиной пять, семь или пятнадцать аминокислот. Если бы эта гипотеза оказалась верна, то, зная структуру каждого короткого участка, можно было бы рассчитать упаковку всего белка, собрав ее из этих фрагментов.
Но все оказалось несколько сложнее: короткие блоки с одинаковыми последовательностями принимают разные конформации. Но число вариантов ограничено. Исследователи проверили, есть ли корреляция между набором аминокислот фрагмента и его формой. Оказалось, что для коротких и для длинных блоков взаимосвязь отсутствует: либо одной последовательности соответствует много структур, либо одной структуре много последовательностей. А вот для участков средней длины (8–10 аминокислот) корреляция очень высокая.
Rosetta использует эту информацию во время глобальной оптимизации. На основании структур из базы данных белков перед началом расчетов составляют библиотеку фрагментов длиной девять аминокислотных остатков. На каждом шаге алгоритма Монте-Карло программа выбирает случайный участок моделируемого белка из девяти аминокислот и ищет в созданной библиотеке фрагменты с такой же или похожей последовательностью. Из найденных фрагментов Rosetta случайным образом выбирает один и меняет структуру участка белка на конформацию из библиотеки. В итоге меняется глобальная упаковка молекулы (рис. 5).
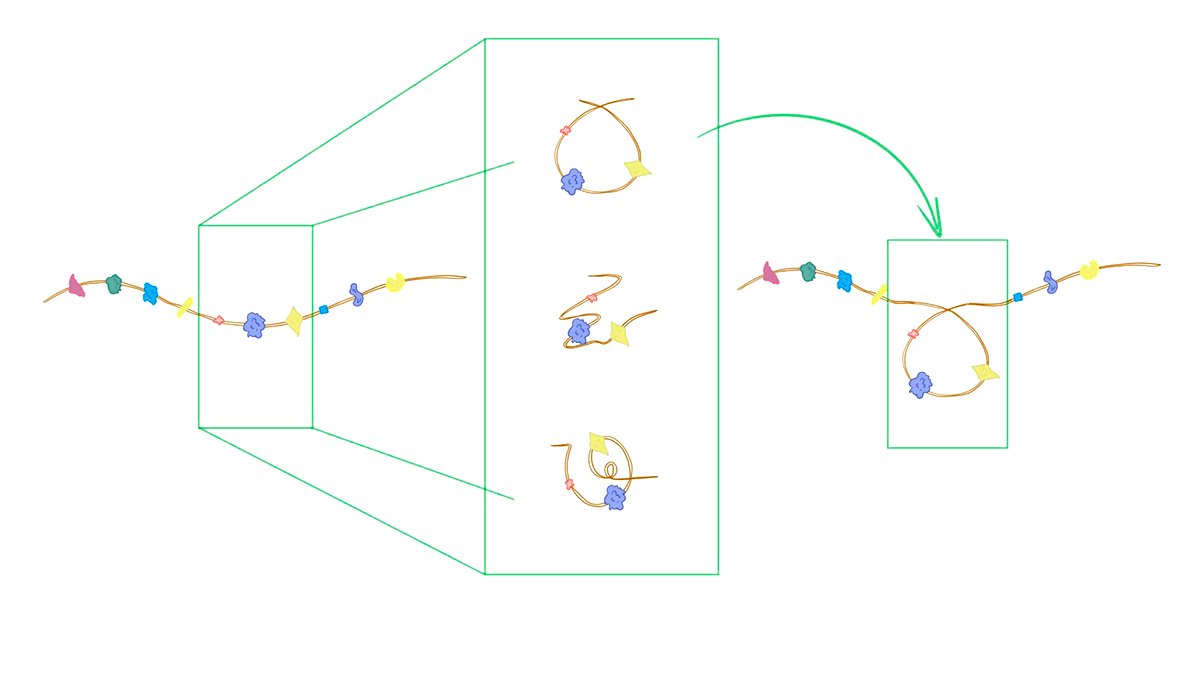
Рисунок 5. Шаг моделирования. Слева схематично показана структура перед началом цикла. В белке выбирают короткий участок из девяти аминокислот: все изменения затронут только его. Еще до начала расчетов составляют библиотеку фрагментов (в центре) — в ней хранятся самые популярные конформации для всех последовательностей длиной 9. В этой библиотеке ищут фрагменты с таким же (или похожим) набором аминокислот, что и у выделенного участка. Структуру этого участка заменяют на конформацию случайно выбранного на предыдущем шаге фрагмента. В итоге упаковка белка меняется (справа). Такой алгоритм напоминает моделирование по гомологии: мы пользуемся тем, что близкие последовательности укладываются похожим образом. Но Rosetta использует информацию только о коротких участках: это позволяет предсказывать структуру для любого белка, даже если похожих белков нет в базе данных PDB. Моделирование по гомологии в таком случае не сработает.
рисунок Васили Сулеймановой по [17]
Локальная оптимизация
После первого шага моделирования мы получим глобальную форму «скелета» белка, и нам останется упаковать боковые группы аминокислот. Они могут принимать только несколько дискретных конформаций — ротамеров (это было показано с помощью теоретических расчетов). В XX веке, когда только начали появляться данные высокой точности о структурах биомолекул, результаты этих вычислений были подтверждены экспериментально [19]. С тех пор на основе базы данных белков ученые составили библиотеки ротамеров [20], одну из которых Rosetta использует во время локальной оптимизации [21].
Алгоритм использует уже знакомый нам метод Монте-Карло. Шаг моделирования состоит из случайного выбора аминокислоты и замены ее конформации на структуру ротамера из библиотеки. Упаковку «скелета» белка при этом фиксируют . Дальше всё как обычно: вычисление и сравнение энергии, критерий Метрополиса, следующий цикл. Таким образом оптимизируют положение всех аминокислот, и на этом моделирование заканчивается — получается одна структура.
Это не совсем правда. Во время локальной оптимизации глобальная упаковка тоже может немного меняться. Шаг моделирования делает одно из двух действий: или меняет положения боковой группы, или немного двигает «скелет» белка. Это не масштабные изменения, как во время первого шага моделирования — они затрагивают максимум три аминокислоты и не приведут к изменению топологии белка.
Эти локальные движения глобальной структуры нужны, чтобы исправить ошибки, возникающие при составлении библиотеки фрагментов. Когда при анализе базы данных PDB находят два участка с одинаковой последовательностью и похожими конформациями, им сопоставляют одну усредненную запись. То есть структуры фрагментов идеализированы, а небольшие локальные движения «скелета» позволяют получать более реалистичные укладки.
Итак, для предсказания структуры Rosetta запускает одновременно множество имитаций, в результате которых получается набор упаковок. Программа их кластеризует и выбирает лучшую укладку. Каждый отдельный расчет состоит из глобального и локального этапов. В обоих важную роль играет функция оценки энергии. Но мы до сих пор не обсуждали, какая она в Rosetta. Пришло время разобраться.
Функция энергии
Rosetta решает разные задачи на двух стадиях моделирования. Сначала ищут общую форму «скелета» белка. Что при этом будет с боковыми группами — неважно. Упаковка ротамеров — дело второго этапа. Из-за этих различий энергия в Rosetta также оценивается по-разному при глобальной и локальной оптимизациях (рис. 6).
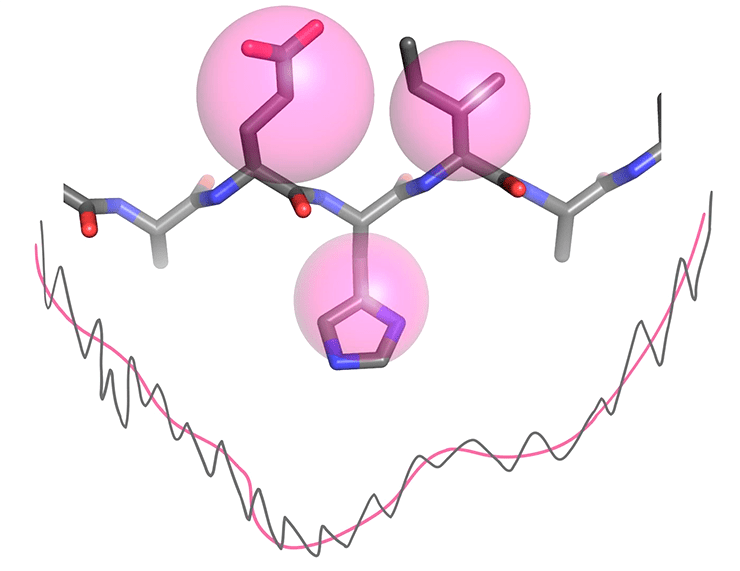
Рисунок 6. Упрощенный и полноатомный профили энергии. При поиске глобальной формы белка используется упрощенное представление аминокислот: боковые группы заменяются одним шариком. Это заметно уменьшает число взаимодействующих частиц и сглаживает профиль энергии. В результате мы реже будем застревать в локальных минимумах, и свертка белка пройдет гораздо быстрее. При упаковке аминокислот нам уже важно положение всех атомов, поэтому используется максимально полное описание энергии.
рисунок авторов статьи
Упрощенная и полноатомная функции безусловно различаются, но качественно они устроены одинаково [21]. Они включают в себя около 10 слагаемых, каждое из которых описывает определенное свойство белка. Некоторые оценивают локальные параметры упаковки: выгодно ли иметь такие углы между атомами? Другие оценивают глобальные свойства упаковки: компактно ли упакован белок? Важная характеристика энергетических функций Rosetta — комбинация слагаемых, опирающихся на физические законы и статистические модели.
Первая группа использует наши знания о взаимодействиях между атомами. Преимущество такого подхода к вычислению энергии — опора на фундаментальные законы. Но в этом же и его слабость: абсолютно честно мы можем описать только очень простые молекулы, для белков мы вынуждены использовать приближения, как, например, в молекулярной динамике [4]. Во время моделирования ошибки будут накапливаться с каждым шагом, что для длительных траекторий приведет к серьезным отклонениям от действительности [22]. Фолдинг протекает достаточно медленно (в среднем занимает несколько миллисекунд; для молекулярных процессов это медленно), а значит, для предсказания структуры рассчитывать энергию только на базе физических законов не стоит.
Вторая часть функции оценки Rosetta использует информацию из базы данных PDB. Работает это примерно так. Мы хотим оценить, насколько выгодна определенная упаковка. Мы берем аминокислоту и считаем, сколько у нее «соседей» (других аминокислот в сфере заданного радиуса). Мы также считаем среднее число «соседей» для аминокислоты такого же типа, используя информацию из PDB. Чем больше разница между двумя вычисленными значениями, тем меньше вероятность, что эта аминокислота в реальности находится в таком положении. В таком случае Rosetta увеличивает оценку энергии белка .
Помимо числа соседей Rosetta анализирует и другие структурные характеристики аминокислот. Все метрики основаны на сравнении параметров данной конформации с распределениями из PDB.
Такой подход явным образом не опирается на физические законы. Но все укладки, опубликованные в базе данных PDB, существуют в природе, а значит, они отражают фундаментальные принципы взаимодействий. По правилу транзитивности, и статистические модели Rosetta опираются на законы физики. Но почему не оценивать энергию, исходя только из информации, извлеченной из репозитория PDB? Ведь физика там уже «зашита». Зачем нужно явно использовать фундаментальные законы?
Всё дело в эволюции. За миллионы лет она создала множество белков, каждый из которых выполняет определенную функцию. Добиться такого разнообразия удалось за счет комбинирования различных типов взаимодействий: одни молекулы стабилизируются в основном за счет электростатики, другие — за счет гидрофобного эффекта [6], третьи еще за счет чего-то. Каждому физическому закону будет соответствовать своя статистическая модель, а при анализе всей базы PDB мы получим одну усредненную и потеряем важные детали. Можно конечно таргетировать поиск (выбирать только белки, похожие на тот, для которого мы хотим предсказать структуру), но это уже моделирование по гомологии [8]. Да и такой подход не позволит создавать новые, не похожие на природные, молекулы.
Комбинация физических законов и статистических моделей — ключ к успеху. Два этих способа расчета энергии успешно корректируют ошибки друг друга. Rosetta использует именно такой подход для моделирования фолдинга, что позволяет в некоторых случаях предсказывать конформации белков с точностью, достигающей 2 Å. На ежегодных соревнованиях по предсказанию структур CASP ученые из Института белкового дизайна всегда в лидерах [5].
Мы в общих чертах познакомились с тем, как Rosetta сворачивает аминокислотные последовательности, чтобы рассчитать упаковку белков. Но для создания новых молекул с новыми функциями нужны другие алгоритмы. Улучшение белков — первый шаг в сторону дизайна. На этом примере мы разберемся, как ученые из группы Бейкера адаптировали свои методы, чтобы создавать новые молекулярные машины.
Улучшение белков
Сначала давайте разберемся, что вообще это значит — улучшить белок?
Всё зависит от наших целей. Любой белок выполняет определенную функцию (биохимическую, сигнальную, иммунную и другие). По разным причинам мы можем захотеть, чтобы он выполнял свою работу быстрее или медленнее, при более высоких или низких температурах, только в клетках определенного типа. Так вот если мы заставим белок исполнять наши желания, то мы его улучшим.
Ферменты — это класс белков, которые ускоряют химические реакции. В последнее время их всё чаще используют в промышленности [23]. Например, компания Novozymes улучшает ферменты для разработки экологичных стиральных порошков и топлива, а также увеличения эффективности фермерских хозяйств. Многие промышленные ферменты должны работать при высоких температурах, что делает термостабилизицию белков весьма распространенным способом улучшения [24].
Как мы обсуждали в начале главы «Rosetta», при нагревании белки в какой-то момент вообще теряют трехмерную упаковку. Вместе с формой теряется и функция. Чем устойчивее структура, тем при бóльших температурах она будет работоспособной. Однако для успешной работы фермента важна гибкость в его активном центре — месте, где непосредственно происходит химическая реакция. И это добавляет сложностей при создании термостабильных молекулярных машин: с одной стороны нужно сделать упаковку устойчивее, с другой — сохранить подвижность в активном центре.
Ученые из группы Бейкера использовали Rosetta для улучшения белков. Они создали работающую при более высоких температурах дрожжевую цитазиндеаминазу [25]. Это фермент, превращающий цитозин в урацил. У него нет важного промышленного значения, но его каталитические и структурные свойства были хорошо известны (а потому его взяли в качестве объекта исследования). Ученые смогли увеличить температуру стабильной работы фермента на 10 °C и продлить время работы при 50 °C в 29 раз (рис. 7).
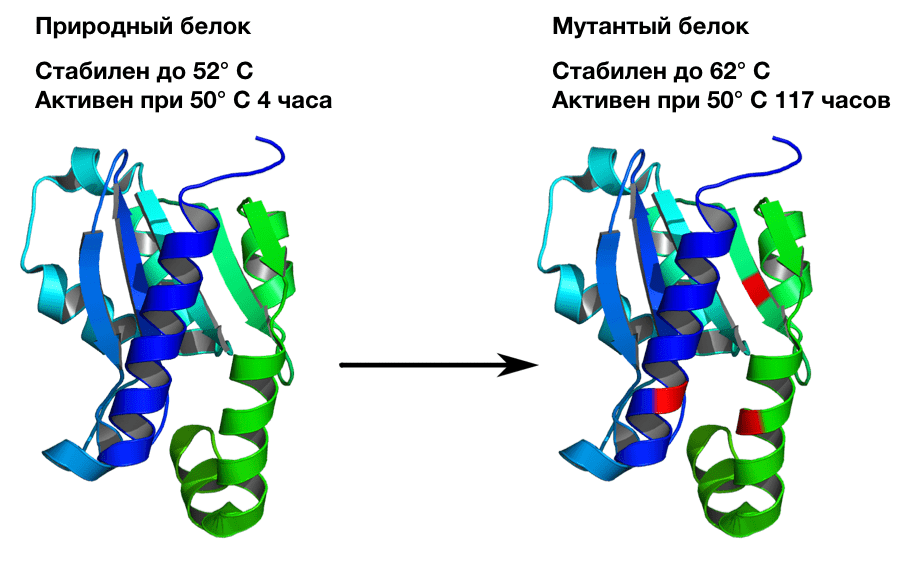
Рисунок 7. Термостабилизация цитазиндеаминазы. Для улучшения белков ученые немного изменили алгоритм Rosetta. По сути, глобальную форму белка мы знаем еще до начала моделирования. Остается только проверить, есть ли последовательность, с которой фермент будет еще стабильнее? На локальном шаге предсказания структуры Rosetta перебирает конформации боковых групп аминокислот. Тогда аминокислоты были фиксированы — каждая занимала в последовательности свое место. При улучшении белков, на каждом шаге перебора локальных упаковок ученые добавили возможность изменять аминокислоту. Это позволило одновременно с небольшими шевелениями структуры перебирать последовательности. Энергию оценивали с помощью той же функции, что и при предсказании структуры.
В результате ученые получили набор белков одинаковой формы, но с разными последовательностями. Они составили список наиболее частых аминокислотных замен и исключили из него те, которые затрагивали активный центр, который должен оставаться гибким. Затем они экспериментально отобрали три мутации из списка и получили новую цитазиндеаминазу. Она сохраняла упаковку вплоть до 62 °C (что на 10 градусов выше, чем у оригинального фермента). А при 50 °C новый белок работал в 29 раз дольше исходного.
рисунок авторов статьи по [25]
Термостабильность — далеко не единственное качество белков, поддающееся улучшению. Можно, например, научить фермент связываться с немного другим субстратом, или совершать больше химических реакций в единицу времени. Ученые из группы Бейкера пошли по такому пути и создали белок KumaMax, способный расщеплять ɑ-глиадин — небольшой белок, один из компонентов глютена, который мы все употребляем в пищу вместе с хлебом. В нашем организме не существует фермента, который расщеплял бы ɑ-глиадин. Другие белки разбираются на мелкие части, но не ɑ-глиадин: после него в кишечнике остается большой пептид длиной в 33 аминокислоты. Для большинства людей это не проблема, но примерно у 1% возникает аутоиммунный ответ: собственные клетки начинают атаковать кишечник и деформируют кишечные ворсинки (рис. 8), что приводит к воспалению и ухудшает пищеварение. Это заболевание называется целиакией (или непереносимостью глютена). В настоящее время единственным способом лечения является изнуряющая диета. Но кажется, ученые из Института белкового дизайна нашли решение (рис. 8).
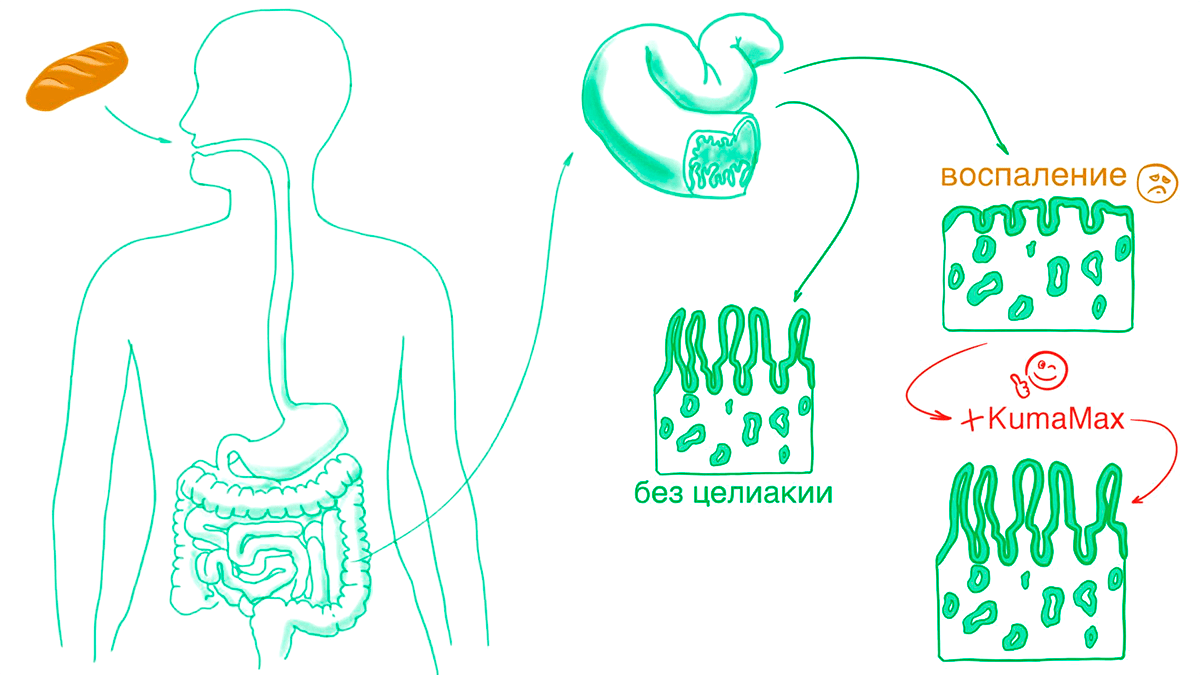
Рисунок 8. Целиакия и ее лечение. Ученые из группы Бейкера нашли природный фермент, который работал в кислой среде (напомним, что в желудке у нас очень «кисло»). Этот белок эффективно расщеплял пептид, похожий на фрагменты ɑ-глиадина. Поэтому первым делом исследователи оптимизировали активный центр фермента, чтобы он специфично связывался с производными ɑ-глиадина. Дальше они добавили несколько мутаций, стабилизирующих форму и улучшающих эффективность. В результате ученые создали новый белок KumaMax, который расщепляет более 90 процентов ɑ-глиадина в течение часа [26]. Так как он может существовать в кислой среде желудка, то он прямо там и разбирает пептид на маленькие кусочки, не давая ему шансов добраться до кишечника и привести к неприятным последствиям.
рисунок Васили Сулеймановой
Исследователи из команды Бейкера не остановились на создании KumaMax [26]. Они продолжили улучшать селективность и эффективность белка и создали вариант Kuma030 [27]. Он работал эффективнее KumaMax даже при более низких концентрациях. На базе этих исследований появился стартап PvP biologics. Компания занималась дальнейшим улучшением фермента. В феврале 2020 года, после успешного завершения первой фазы клинических испытаний лекарства от целиакии, японский фармацевтический гигант Takeda приобрел PvP biologics за 330 миллионов долларов. Так что миллионы людей, страдающих от целиакии, могут надеяться на скорое появление лекарства. Это одна из самых громких историй успеха белкового дизайна, а Rosetta — одна из составляющих этого успеха.
Rosetta оказалась эффективна как для предсказания структур, так и для дизайна. Но это стало возможным во многом благодаря коллективу Института белкового дизайна. Бейкеру удалось собрать очень сильную команду, которая смогла не просто разработать программу, но и применить ее с пользой.
Безусловно, желающих создавать новые молекулы с помощью Rosetta — масса, но до сих пор успеха достигали только сотрудники Института белкового дизайна. Проблема в том, что использовать программу сложно: огромное количество модулей и настроек усложняют жизнь пользователям. Ученые из группы Бейкера — практически единственные, кто знает, какой алгоритм использовать для какой задачи.
Чтобы облегчить жизнь остальным исследователям, Дэвид Бейкер с коллегами основали компанию CyrusBio. Стартап занимается разработкой User Friendly версии Rosetta. Клиентами CyrusBio являются 13 из 20 крупнейших фармацевтических компаний мира. Но что их привлекает? Разве достаточно уметь хорошо предсказывать структуры и улучшать белки, чтобы привлечь внимание гигантов рынка лекарств? В следующей главе мы подробно обсудим, какие задачи дизайна Rosetta, а значит и CyrusBio, позволяет решать!
Приступим к дизайну
Помимо сборки по инструкции и апгрейда, в LEGO можно играть еще одним способом: самостоятельно придумывать модели и собирать их из доступных деталей. Получаются новые конструкции, которые не приходили в голову создателям LEGO. С белками дела обстоят так же. Создание несуществующих в природе белков позволит расширить выбор возможных упаковок, а значит и функций. Подобные молекулы могут оказаться полезными для лечения заболеваний, контроля молекулярных процессов, производства бытовой химии и даже пива. В этой части статьи мы узнаем, какие белки удалось создать команде Дэвида Бейкера с помощью Rosetta.
Новая упаковка белка
Ученые из команды Бейкера продемонстрировали, что Rosetta подходит для дизайна, и создали новый белок. Эта задача сильно напоминает проблему улучшения: вместо поиска оптимальной последовательности для природной упаковки, необходимо подобрать аминокислоты к несуществующей в природе конформации. Однако сразу возникает вопрос: любая ли выбранная укладка белка будет стабильна? Очевидный ответ — нет. Если мы захотим, чтобы белок образовывал прямую линию, то никакая последовательность аминокислот не сможет обеспечить ее стабильность: такая нитка будет самопроизвольно запутываться по энтропийным причинам и из-за гидрофобного эффекта (см. врезку «Энергия и фолдинг»).
Как выбрать упаковку, которая будет стабильной? Команда Дэвида Бэйкера применила простое правило: неполярные и незаряженные (гидрофобные) аминокислоты спрятаны от воды, окружающей белок. И наоборот: полярные и заряженные (гидрофильные) аминокислоты находятся на поверхности белка и взаимодействуют с водой . Этот принцип продиктован гидрофобным эффектом, играющим важнейшую роль в молекулярной биологии и фолдинге белка [6].
Важно уточнить, что это правило действует для сравнительно небольших водорастворимых белков. Мембранные же белки, погруженные в неполярную среду из «хвостов» фосфолипидов [28], устроены иначе: их поверхность устлана также неполярными остатками. В активном центре белка или в области связывания лиганда гидрофильные аминокислоты также встречаются регулярно. Они обеспечивают возможность реакции, специфичность связывания субстрата и лиганда.
Ученые нарисовали на листе бумаги новую упаковку белка, которая не была представлена среди белковых топологий, рассчитанных с помощью сервера TOPS . Исходя из рисунка, они сформировали ряд ограничений, которым должен соответствовать белок, и запустили немного измененный алгоритм предсказания. Вместо использования стандартной функции энергии, они проверяли, удовлетворяет ли новая структура заданным условиям. Для каждой полученной конформации они предсказали оптимальные последовательности (рис. 9). При подборе последовательности на каждом шаге Монте-Карло мы выбираем, какую аминокислоту менять: на что ее заменить и какая будет новая конформация. При дизайне нового белка появилось дополнительное условие: аминокислоты на поверхности глобулы заменялись только на гидрофильные остатки [29].
Более популярной является классификация SCOP — Structural Classification of Proteins, но в этой работе Бейкер использовал базу TOPS.
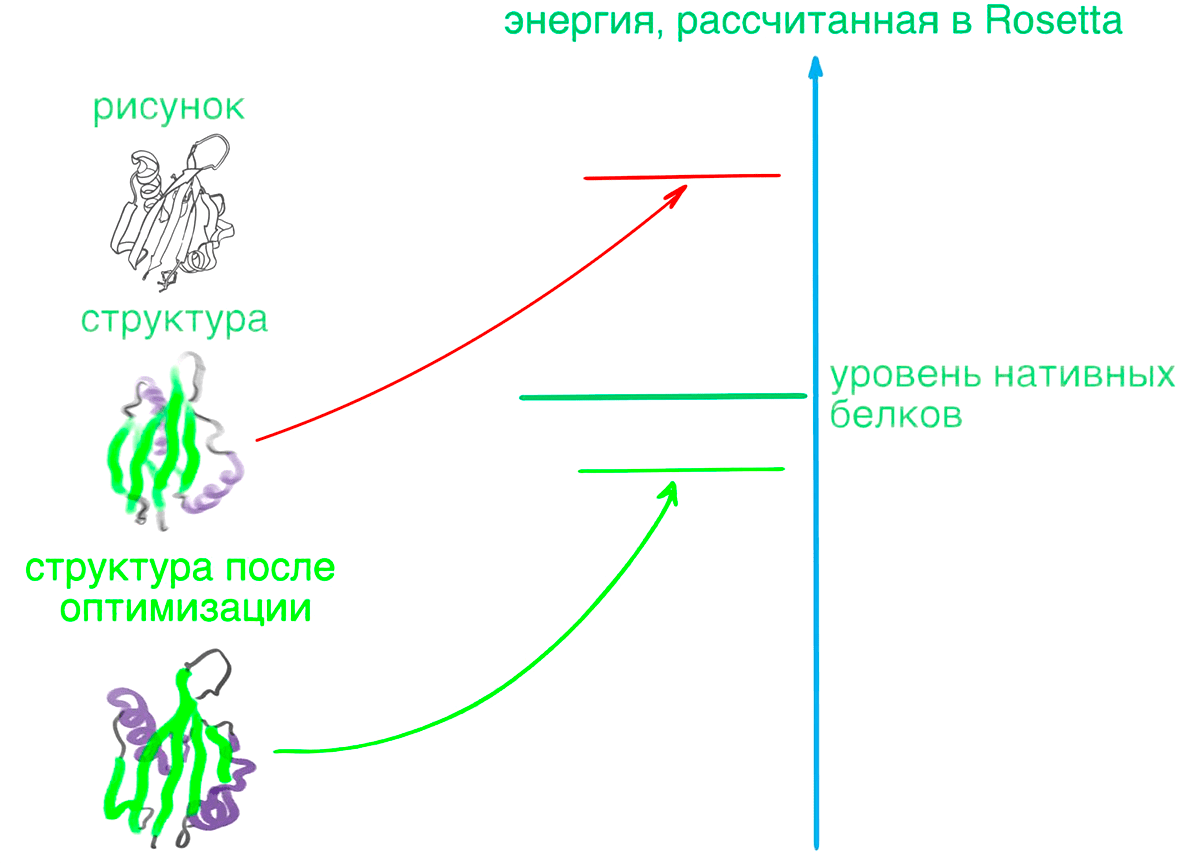
Рисунок 9. Дизайн нового белка. Сначала генерировали структуры из рисунка белка, оптимизировали для них последовательности и с помощью Rosetta оценивали энергию полученных молекул. Она оказалась гораздо выше энергии природных белков схожего размера (также рассчитанной в Rosetta): вероятно, ограничения, использованные для получения структур, привели к невыгодным упаковкам. На этом этапе ученые справились с дизайном хуже эволюции. Но они не остановились на достигнутом. Чтобы снизить энергию созданных белков и исправить ошибки шага генерации структур, запустили дополнительную локальную минимизацию методом Монте-Карло: последовательность зафиксировали, а изменяли только положения не более чем пяти аминокислот. Эти изменения крупнее движений остова при локальной оптимизации (см. раздел «Моделирование фолдинга»), но всё еще не способны изменить глобальную упаковку белка. После минимизации запускали новый поиск оптимальной последовательности. Такие процедуры повторяли до тех пор, пока энергия полученных белков не стала меньше энергии нативных белков, рассчитанной в Rosetta.
рисунок Васили Сулеймановой по [29]
Ученые выбрали одну из предсказанных последовательностей, синтезировали белок, вырастили кристаллы и получили экспериментальную структуру. Она оказалась очень похожа на предсказанную (среднеквадратичное смещение атомов между предсказанной и экспериментальной упаковками — 1,2 Å). Эта работа продемонстрировала возможность создавать новые белки с помощью Rosetta. Но конкретно этот белок не умел делать чего-то особенного. Дизайн новых, не созданных эволюцией, функциональных молекул — более сложная задача. В следующих разделах мы посмотрим, как ученым из группы Бейкера удалось справиться с ней.
Связывающие лиганды белки
Многие природные белки активируются в ответ на связывание с небольшой молекулой — лигандом. Лиганд передает сигнал — пора начать работать иначе. Многие лекарства — как раз такие малые молекулы. Они связываются с белками, которые начали работать неправильно, и пытаются «починить» их. Важным шагом на пути к созданию новых лекарств является драг-дизайн — поиск лигандов, которые способны повлиять на работу «неисправных» белков человека. «Биомолекула» рассказывала о нем в подробном материале «Драг-дизайн: как в современном мире создаются новые лекарства» [30]. Ученые разработали множество вычислительных методов для увеличения эффективности драг-дизайна [31].
В институте, возглавляемом Бейкером, к проблеме подошли с другой стороны: они решили создать белок, который будет эффективно связывать лиганд [32]. Такое решение будет полезно, например, для очищения организма от токсинов: вводим смесь молекул, они точечно связывают вредные вещества — и пациент снова здоров. В качестве лиганда-мишени они выбрали растительный стероид дигоксигенин. Его используют как нерадиоактивную молекулярную метку, в том числе для гибридизации in situ.
Но как создать белок, эффективно связывающий лиганд? Исследователи применяли следующий протокол (рис. 10) [33]:
- Создавали различные варианты ближайшего окружения лиганда в сайте связывания, которые стабилизировали бы лиганд. Для этого в пространстве размещали несколько аминокислот, которые способны образовывать водородные или ван-дер-ваальсовы связи с атомами лиганда.
- Из заранее созданной базы данных возможных упаковок белка (это просто «скелеты» из базы данных PDB) выбирали такие, в которые можно вписать аминокислоты ближайшего окружения из пункта 1.
- Структуры с лигандом минимизировали с помощью метода Монте-Карло: вносили локальные изменения упаковки, как при дизайне нового белка в разделе «Новая упаковка белка».
- Если форма получившегося «кармана» отличалась от формы лиганда, то конформацию отбрасывали.
- Если структуры белка, минимизированная с и без лиганда, сильно различалась, то конформацию отбрасывали.
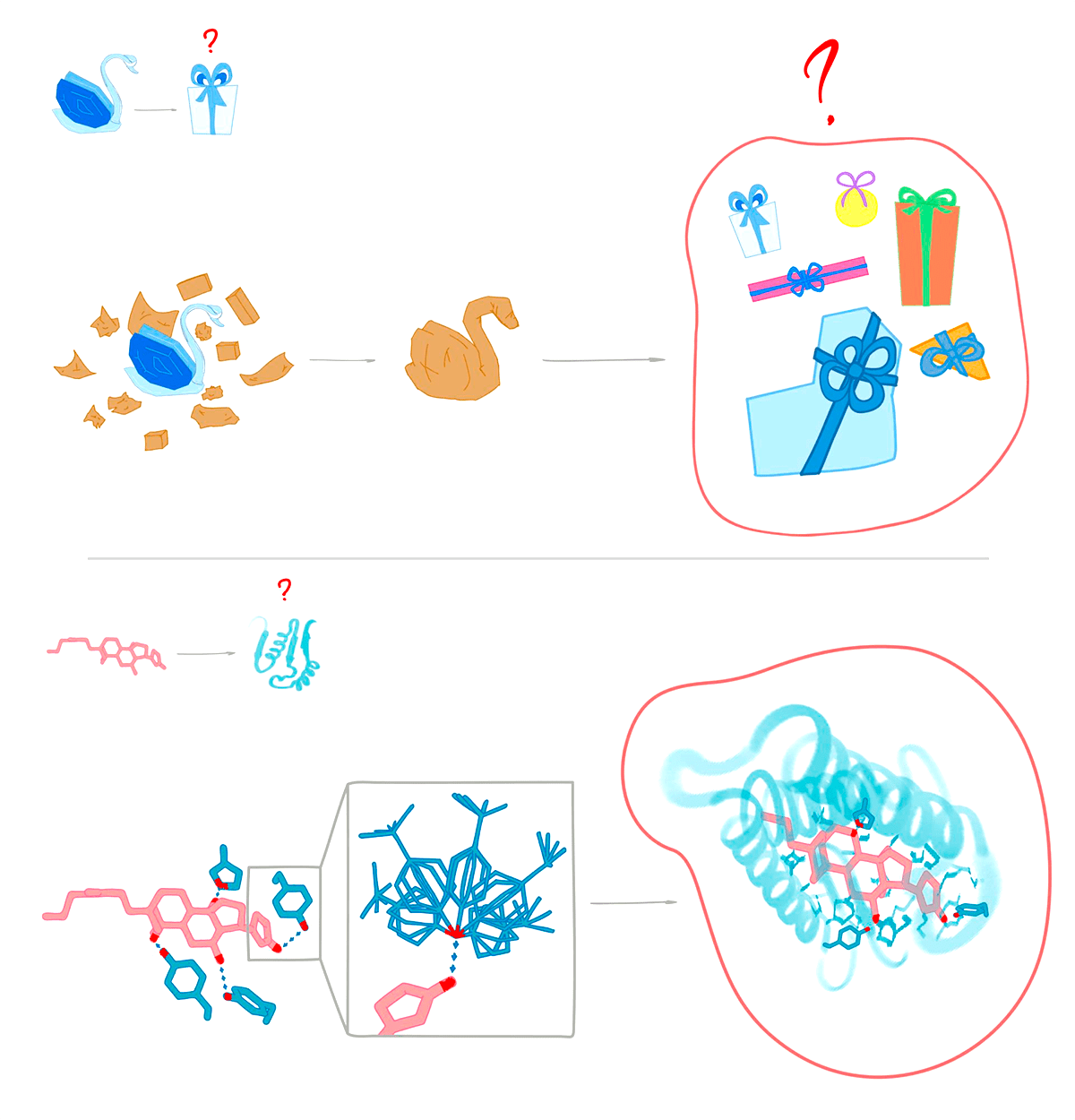
Рисунок 10. Дизайн сайта связывания. Процесс создания белка, связывающего лиганд, напоминает упаковку хрупкого подарка. Чтобы не разбить по пути, мы сначала его оборачиваем мягким материалом. Дальше мы подбираем подарочную коробку: маленькая не подойдет — подарок туда просто не влезет; большая тоже — подарок будет летать из угла в угол. Найдя коробку нужного размера, мы проверяем, что подарок надежно закреплен: никакие части не двигаются. В такой упаковке мы довезем презент в целости и сохранности. С белком то же самое: ищем локальное окружение лиганда; выбираем упаковки, совместимые с локальным окружением; проверяем, что лиганд «надежно» помещен в пакет связывания.
рисунок Васили Сулеймановой
Группа Бейкера создала новый белок с высокой аффинностью к дигоксигенину, измеренной in vitro. В экспериментально определенной структуре лиганд занимал ровно то положение, которое предполагалось при дизайне. При этом связывание дигоксигенина было специфичным: при небольшом изменении лиганда связывание ухудшалось. К такому же результату приводили мутации аминокислот, образующих сайт связывания.
Умение создавать белок, связывающий определенный лиганд, открывает много новых возможностей.
Наличие в крови определенных малых молекул часто сопутствует конкретной болезни. А раз так, то для диагностики можно создать белок, специфично связывающий маркер данного заболевания — возьмем образец крови пациента и добавим к нему разработанные молекулы, которые дополнительно свяжем со светящимися антителами. По уровню излучения мы сосчитаем концентрацию лигандов в организме больного. Описанный (сильно упрощенно) подход называется иммуноферментным анализом и широко применяется в фармацевтике и медицине [45].
Другое применение, которое мы коротко обсуждали в начале раздела, — очищение организма от токсичных соединений: вводим белок в организм, он связывает отравляющее вещество и не позволяет ему навредить клеткам. Но, пожалуй, самая важная на данный момент область — дизайн ферментов. Об этом мы подробно поговорим в следующем разделе.
Новые ферменты
Напомню, что ферменты — это белки, ускоряющие химические реакции. Во время химической реакции одно вещество преобразуется в другое. Обычно начальная (реактант) и конечная (продукт) молекулы стабильны, то есть находятся в локальном энергетическом минимуме. Чтобы провести реакцию, необходимо вытащить реактант из локального минимума, протащить его через переходное состояние с более высокой энергией, после чего он уже свалится в новый локальный минимум — продукт. Ферменты уменьшают разницу энергий между переходным состоянием и реактантом — это основной принцип их работы (рис. 12).

Рисунок 12. Принцип работы ферментов. При химических реакциях изменяется состав вещества: реактант (слева) превращается в продукт (справа). Такое преобразование происходит через переходное состояние с высокой энергией. Ферменты стабилизируют переходное состояние и тем самым уменьшают энергетический барьер химической реакции.
рисунок Васили Сулеймановой
Для дизайна ферментов необходимо знать путь химической реакции — через какое промежуточное состояние она протекает. Для этого можно использовать квантовые вычисления [46]. Когда промежуточное состояние известно, нужно создать такой фермент, который будет стабилизировать его. Эта задача аналогична задаче о поиске белка, связывающего лиганд, и решается по схожему алгоритму: подбор локального окружения, выбор скелета белка, проверка полученных конформаций [47].
Группа Бейкера запатентовала описанный метод дизайна ферментов и успешно его использовала для ускорения реакции Дильса—Альдера (рис. 13а) [48], элиминации Кемпа [49] и ретроальдольной реакции [50]. В природе не существует катализирующих ферментов для этих широко используемых в промышленности реакций. Поэтому создание молекул, их ускоряющих, имеет прямое прикладное значение.
Успешный дизайн искусственных ферментов привел к созданию компании Arzeda — одной из дочерних компаний Института белкового дизайна. Стартап использует и улучшает методологию, описанную в этом разделе, для дизайна новых промышленных ферментов. За 12 лет существования Arzeda привлекла порядка 20 миллионов долларов и сотрудничает, например, с BP.
При создании белков, связывающих лиганд, и новых ферментов ученые из Института белкового дизайна использовали базу данных стандартных упаковок (см. раздел «Связывающие лиганды белки»). Но что если нужно создать фермент определенной формы? Это позволит дополнительно управлять взаимодействиями с другими белками или создавать ферменты, способные работать в условиях, при которых не могут существовать природные белки. Для одновременного контроля связывания с лигандом и формы белка нужны были новые методы, и исследователи их разработали. С их помощью они создали маленький флуоресцентный белок определенной формы.
Светящиеся белки на заказ
Если белок в качестве лиганда связывает флуорофор — молекулу, которая переизлучает поглощенный свет, — то получится светящийся (флуоресцентный) белок . Ученые под руководством Дэвида Бейкера использовали алгоритмы дизайна лиганд-связывающих белков заранее выбранной формы и создали белок, имеющий форму β-бочки — один β-лист замкнутый в цилиндр, который связывал флуорофор DFHBI.
Флуоресцентные белки широко используются для изучения молекулярных механизмов живых организмов наряду с другими флуорофорами [53]. Зеленый флуоресцентный белок (GFP) — один из наиболее ярких представителей. За его открытие и изучение в 2008 году Осаму Шимамура, Роджер Тсин и Мартин Шалфи получили Нобелевскую премию [54].
Дизайн β-бочки долгое время оставался нерешенной задачей. Такие белки существовали в природе, но попытки искусственно изменить радиус или другие параметры бочки не были успешны [55]. Фундаментальные принципы, позволяющие природе создавать β-бочки, оставались непонятны исследователям.
Итак, проект по созданию флуоресцентной β-бочки состоял из двух сложных задач: создать новую устойчивую цилиндрическую упаковку; внутри нее создать сайт связывания лиганда [56]. Мы поступим немного непоследовательно и сначала обсудим вторую проблему. Для ее решения необходимо было улучшить стандартный алгоритм разработки лиганд-связывающих белков. Напомню, раньше после дизайна сайта связывания ученые выбирали из базы данных возможных упаковок белка те, в которые можно вписать предполагаемое локальное окружение лиганда. Но если теперь дополнительно учесть, что белок должен иметь определенную форму, то, скорее всего, нам не подойдет ни одна упаковка. Поэтому разработчики Rosetta создали новый алгоритм, который создавал миллиарды вариантов локального окружения лиганда и упаковок белка, удовлетворяющих заданным условиям. Далее алгоритм искал пары «окружение—упаковка», которые можно совместить друг с другом (рис. 14).
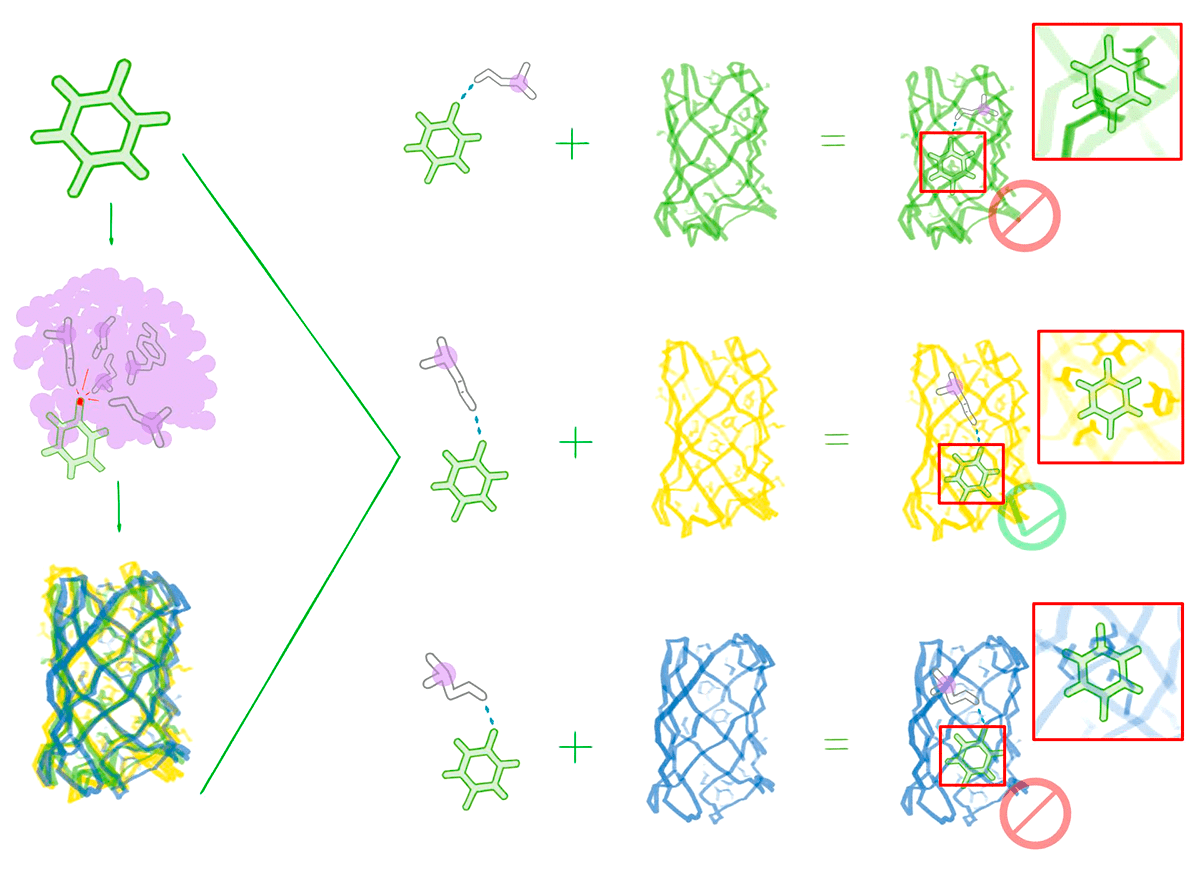
Рисунок 14. Создание белка заданной формы, связывающего лиганд. Сначала создают миллиарды вариантов окружения лиганда. Аминокислоты, образующие с лигандом водородные связи и неполярные взаимодействия, располагают под всевозможными углами и в различных конформациях. Также создают большое число упаковок, отвечающих заранее выбранным условиям. Далее ищут совместимые пары окружения лиганда и конформаций белка. Для флуоресцентной β-бочки с помощью такого алгоритма ученые из Института белкового дизайна смогли получить 2102 варианта упаковок, связывающих флуорофор [56].
рисунок Васили Сулеймановой
Создать неприродную β-бочку оказалось непросто. Это не удавалось сделать никому до Бейкера и с первого раза не удалось и ему. Он честно написал об этом в статье в журнале Nature [56]. Коллектив Института белкового дизайна сначала использовал параметрический подход, который успешно работал для создания суперспиралей [57]. Идея метода простая: составить математические уравнения структуры, которую необходимо создать, и проверить, удовлетворяются ли записанные формулы для предлагаемых дизайнов. Такой подход абсолютно не сработал для β-бочек — после оптимизации структур в Rosetta многие водородные связи, необходимые для стабилизации формы белка, оказались разрушены (рис. 15, левая панель).
Ученые из группы Бейкера обратили внимание, что нарушения в паттерне водородных связей происходили в основном на краях β-бочки. Они добавили дополнительные очень сильные ограничения на водородные связи, чтобы сохранить цилиндрическую форму при моделировании. Ученые заметили, что некоторые аминокислоты оказывались в неестественных положениях. Такие отклонения возможны, только если β-бочка не будет цилиндрически симметричной (рис. 15, правая панель). Параметрический же подход приводил к идеальным круглым структурам, без углов (рис. 15, левая панель). Возможно, именно поэтому он не сработал.
Группа Бейкера не сдалась и изменила стратегию: вместо дизайна через математические формулы, они создали двумерную карту белка, отметили на ней различные ограничения (водородные и пептидные связи, локальную геометрию) и подбирали упаковки, соответствующие этой карте. Этот подход сработал — ученые из института дизайна белков научилась создавать β-бочки (рис. 15).
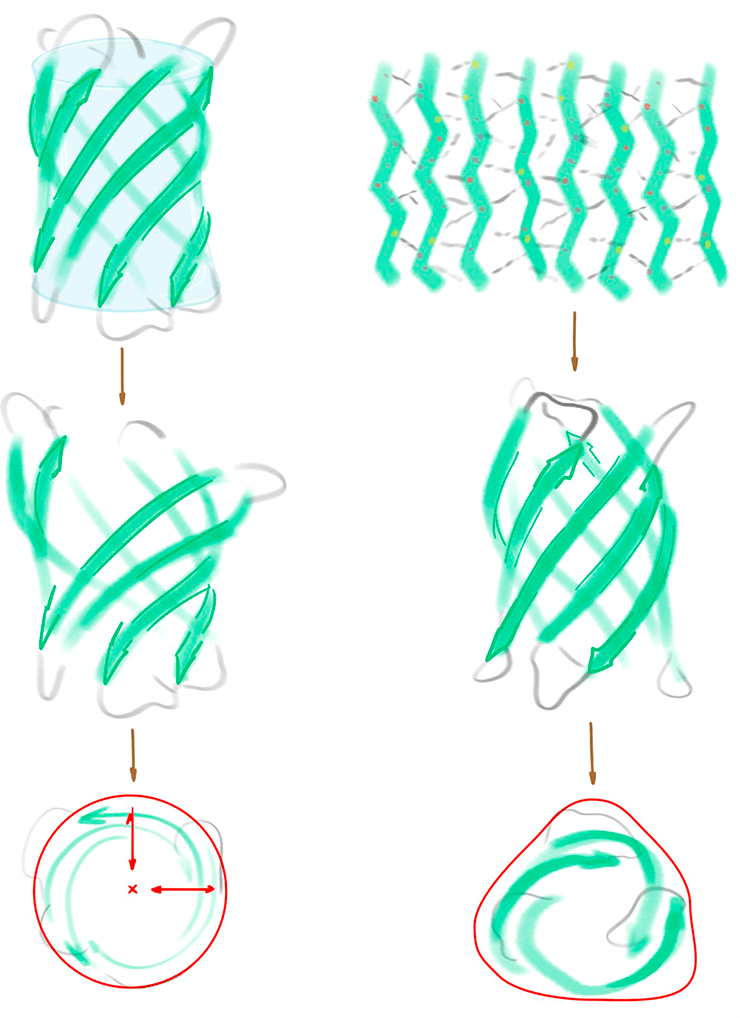
Рисунок 15. Создание β-бочки. Параметрический подход (слева) — запись формул и проверка упаковок на соответствие им — не сработал. Он приводил к симметричным дизайнам с нарушенным паттерном водородных связей. Двумерная карта ограничений (справа), — когда плоская развертка белка с картой особенностей локальной геометрии, водородными и пептидными связями использовалась как набор ограничений при моделировании конформаций белка, — привела к успешному, но несимметричному дизайну β-бочки.
рисунок Васили Сулеймановой
Ученые создали 200 разных упаковок β-бочки и использовали их вместе с новым методом дизайна сайта связывания. В результате получилось 2102 кандидата на роль светящихся белков. Из них 56 дизайнов обладали низкой энергией и только два флуоресцировали в эксперименте. Ученые продолжили оптимизацию, используя как компьютерные, так и экспериментальные методы. В результате им удалось создать белок из 110 аминокислот (сравните с GFP — 238 аминокислот), связывающий флуорофор DFHBI. Он флуоресцировал в бактериях, дрожжах и клетках млекопитающих. Хотя яркость новой светящейся бочки оказалась в 35 раз ниже яркости GFP, маленькие размеры делают ее привлекательной для флуоресцентных экспериментов. Новый метод дизайна лиганд-связывающих белков найдет свое применение при создании новых ферментов (про стартап Arzeda мы уже говорили), а умение создавать β-бочки уже привело к созданию системы транспорта ионов через мембрану.
История создания флуоресцентного белка в очередной раз продемонстрировала, что Rosetta — далеко не единственный критерий успеха Дэвида Бейкера. Целеустремленный коллектив Института белкового дизайна не опустил руки при первой неудаче и придумал новые подходы для создания β-бочки. Многочисленные циклы компьютерной и экспериментальной оптимизации дизайна, проверка in vitro и in vivo — неотъемлемая часть каждого проекта. И все это необходимо только для дизайна одного белка. Но что если мы хотим управлять взаимодействиями белков? Поможет ли здесь Rosetta?
Лекарство от гриппа
Ученые из группы Бейкера решили «хакнуть» белок-белковые взаимодействия и попробовали создать лекарство от гриппа. Грипп — одно из самых распространенных заболеваний на Земле. Ежегодно от него умирает от 290 до 650 тысяч человек. При этом вирус гриппа постоянно изменяется, что существенно осложняет создание лекарств и вакцин против него. Не так давно популярное лекарство «Тамифлю» сдалось под натиском мутаций вируса [58]. «Биомолекула» подробно рассказывала историю вируса гриппа в статье «Неуловимый грипп» [59].
Одним из наиболее важных для развития болезни белков является гемагглютинин: он позволяет вирусу присоединиться к клеткам человека. Многие лекарства и вакцины как раз направлены на нейтрализацию этого связывания. Изменчивость вируса проявляется, в том числе, и в мутациях гемагглютинина. Однако мутации происходят неравномерно по всему белку: где-то они случаются часто, где-то редко. Антитела широкого спектра, которые обеспечивают защиту от большого количества вариантов (штаммов) вируса одновременно, как раз соединяются с консервативными участками — эпитопами.
Ученые из Института белкового дизайна, использовали свои навыки и попробовали создать лекарство от гриппа. Они взяли структуры гемагглютинина и нашли консервативные участки. Исследователи хотели создать небольшой пептид, который бы связывался с гемагглютинином в выбранных местах. Для этого они сначала сгенерировали возможные локальные окружения эпитопов, которые стабилизировали бы контакт с вирусом, и затем подобрали упаковки белков, которые совместимы с предполагаемыми сайтами связывания. Такой подход к дизайну напоминает создание «кармана» для связывающих лиганд белков (см. разделы «Связывающие лиганд белки» и «Светящиеся белки на заказ»).
Исследователи создавали интерфейс взаимодействия двумя разными способами: они или использовали структурную информацию о взаимодействии антител с гемагглютинином, или создавали сайт связывания с нуля (рис. 16).
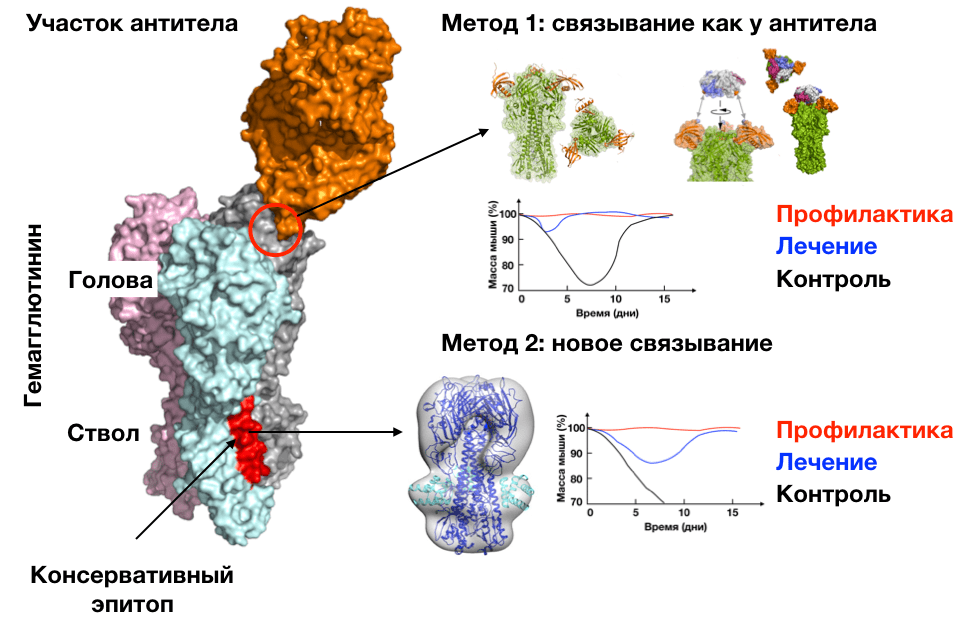
Рисунок 16. Дизайн лекарств от гриппа. Исследователи из Института белкового дизайна создали два потенциальных лекарства от гриппа разными методами. Первый подход — использовать экспериментально известный интерфейс [60]. Ученые взяли структуру комплекса гемагглютинина с антителом, выбрали аминокислоты антитела, отвечающие за контакт и подобрали упаковку белка, совместимую с положением этих аминокислот. Так появилась небольшая молекула, связывающаяся с одним из ключевых белков вируса гриппа. Для дальнейшего увеличения стабильности комплекса исследователи использовали тот факт, что гемагглютинин образует тримерные комплексы. Они взяли тримерный природный белок и на каждом мономере создали интерфейс взаимодействия с белками, разработанными ранее. В итоге получилась молекула, связывающая все три эпитопа гемагглютинина. Такое кратное усиление связывания за счет использования симметрии молекул-мишеней называется авидностью.
Второй подход — создание интерфейса «с нуля» [61]. Исследователи выбрали консервативный эпитоп гемагглютинина и сгенерировали положения аминокислот, которые стабилизировали бы контакт с этим эпитопом. Этот шаг напоминает создание локального окружения при дизайне связывающих лиганд молекул (см. разделы «Связывающие лиганды белки» и «Светящиеся белки на заказ»). Далее они подобрали упаковку белка, совместимую с положением выбранных аминокислот. Получившаяся молекула эффективно взаимодействовала со стволом гемагглютинина. В этом исследовании создать авидный вариант не удалось: симметричные эпитопы находились в середине белка, и чтобы соединить их, нужно «обогнуть» гемагглютинин сверху; для чего нужен очень большой комплекс, который трудно синтезировать, он будет плохо двигаться в организме и вообще, при дизайне можно не учесть взаимодействия, которые в реальности приведут к абсолютно другому связыванию.
Оба потенциальных лекарства оказались эффективными в экспериментах на мышах: при введении молекул до заражения гриппом мыши не демонстрировали признаков заболевания; при введении после заражения — выздоровление проходило гораздо быстрее [60], [62]. Обе молекулы связывались со многими штаммами вируса гриппа, но не со всеми: создать абсолютно универсальное лекарство ученые из института дизайна белков не смогли . На рисунке задействованы панели из публикаций группы Бейкера [60], [62].
рисунок авторов статьи
В экспериментах на мышах исследователи использовали различные штаммы вируса гриппа. Этим объясняется различное поведение контрольных групп.
Группа Бейкера создала два потенциальных лекарства от гриппа [60], [61]. Оба лекарства продемонстрировали эффективность на мышах (рис. 16) [61], [62]. Это позволило Институту белкового дизайна получить 11,4 миллиона долларов на продолжение исследований. Также на основе этих разработок появился стартап Virvio. На данный момент сайт компании не функционирует, а основатели работают в других местах. Возможная причина неудачи — иммуногенность: иммунитет слишком активно реагировал на появление чужеродных молекул. Правда, в исследованиях на мышах ученые этого не обнаружили. Так что, скорее всего, стартап закрылся из-за нехватки финансирования.
Ученые из института, возглавляемого Бейкером, продолжают активно продвигать противовирусные лекарства на основе небольших белков. Во время пандемии COVID-19 они создали пептиды, которые должны препятствовать проникновению коронавируса в клетки человека [63]. По утверждениям ученых, лечение такими молекулами имеет ряд преимуществ перед терапией антителами: их дешевле, легче и быстрее производить. Вдобавок антитела часто вводят пациенту путем инъекции, а небольшие белки возможно доставить в виде капель в нос.
Ученые из команды Бейкера верят в свой подход и в 2018 году создали компанию Neoleukin для проведения клинических испытаний и вывода на рынок потенциального лекарства от рака. Оно было создано аналогично белкам, связывающим гемагглютинин вируса гриппа (рис. 16) и показало эффективность на мышах [64]. Возможно, скоро появится и новая компания, разрабатывающая улучшенные пептиды против гриппа.
Лекарства, если их эффективность подтверждена клинически (к сожалению для многих лекарств на полках аптек это не так), помогают справиться с болезнью после ее начала. Их также принимают и в профилактических целях, но вирусные заболевания можно эффективно предотвратить с помощью вакцинации. Rosetta помогает в разработке новых лекарств, но будет ли она также полезна для дизайна вакцин? Конечно!
Фигуры из белков
Как научить организм находить и уничтожать вирус (или, например, раковые клетки)? «Биомолекула» подробно рассказывала об этом в статье «Разработка вакцин: чем и как имитировать болезнь?» [65]. Ключевым моментом является появление в организме искусственных чужеродных частиц, из которых торчат белки с поверхности вируса (антигены). Сами по себе такие частицы безвредны — они не наделены машинерией, необходимой вирусам для размножения. Иммунная система отреагирует на вторжение и создаст связывающиеся с антигенами антитела. Они долгое время будут сохраняться в организме и активироваться, когда обнаружат вирус. По сути, вакцина — это безопасная версия вируса.
Как белковый дизайн помогает создавать вакцины? Оказывается, что недостаточно научиться производить белки, присутствующие на поверхности вируса. Эффективность иммунного ответа зависит и от геометрии антигенов [66]. И вот здесь методы дизайна будут полезны. Ученые из группы Бейкера создали вакцину в виде сферической наночастицы, которая связывала белок F респираторно-синцитиального вируса человека [67]. У мышей и приматов, которым вводили эти наночастицы, наблюдался в 10 раз более сильный иммунный ответ, чем при введении лучших известных на сегодняшний день вакцин против этого вируса. Участники этого исследования основали компанию Icosavax. Среди продуктов стартапа есть также вакцина от коронавируса, клинические испытания которой должны скоро начаться.
Создание подобных наночастиц включает два этапа: создание сферической основы и присоединение к ней белков вируса. Для решения второй задачи отлично подходят методы, которые использовали ученые при разработке лекарства от гриппа. Нужно всего лишь подобрать оптимальный интерфейс взаимодействия каркаса и белка вируса. Но как сделать каркас?
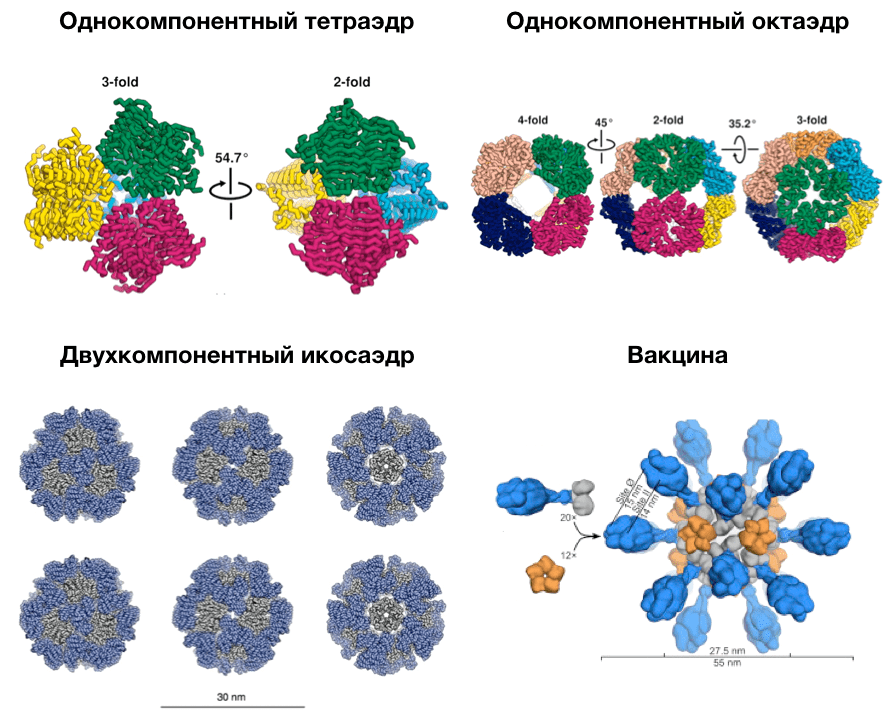
Можно нарисовать, подобрать и попробовать произвести огромный белок нужной формы, но, скорее всего, ни одна клетка не справится с последней задачей. Нужны другие подходы. Ученые из группы Бейкера оптимизировали взаимодействия между небольшими белками так, чтобы они собирались в каркас правильной формы (рис. 17). Им удалось получить стабильные конструкции в виде тетраэдра, октаэдра и икосаэдра (рис. 18) [68–71]. В разных моделях каркас состоял или из одинаковых белков, или из двух разных. Эксперименты показали, что достаточно просто смешать белки друг с другом, и они сами соберутся в нужную форму. Это очень похоже на методику ДНК-оригами, с помощью которой можно создавать разнообразные двух- и трехмерные конструкции из нуклеиновых кислот [72]. С помощью этой технологии уже создают высокоточные молекулярные машины — нанороботы, способные манипулировать отдельными молекулами.
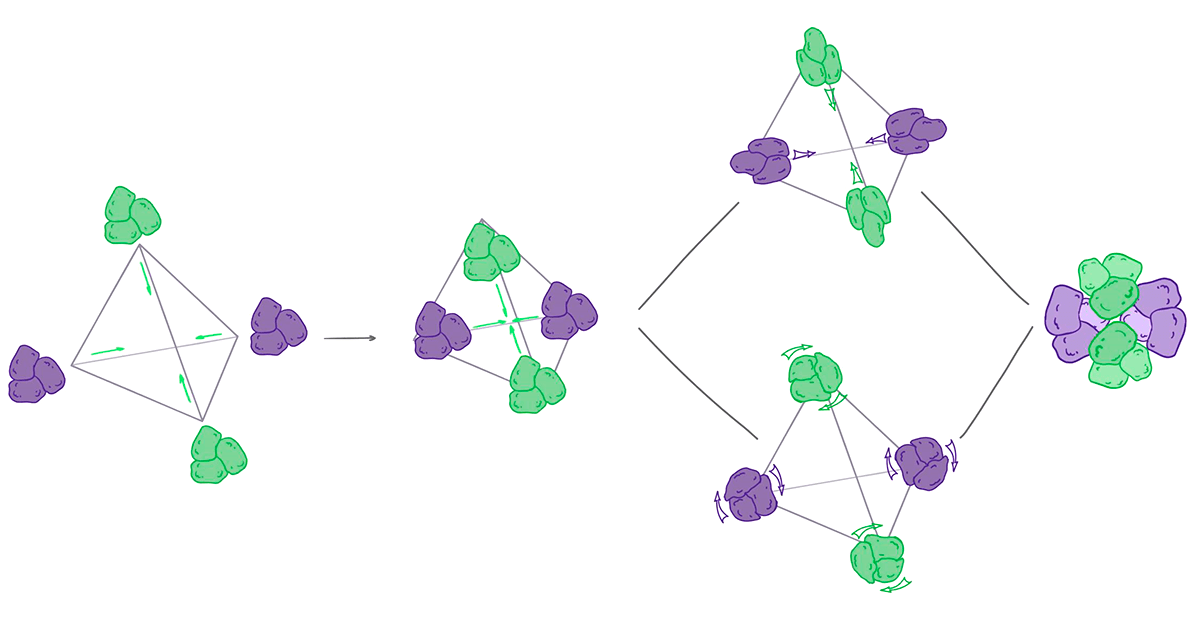
Рисунок 17. Создание симметричных белковых комплексов. Мы разберемся, как ученые из группы Бейкера создавали правильные белковые многогранники, на примере тетраэдра. Правильный тетраэдр имеет четыре оси симметрии третьего порядка, проходящие через его вершины: если повернуть его вокруг любой из них на 120°, он перейдет сам в себя. Исследователи выбрали тримерные белковые комплексы, встречающиеся в природе, и разместили их в вершинах многогранника. Меняя расстояние от центра тетраэдра и ориентацию тримеров, они получали различные интерфейсы взаимодействия природных комплексов в середине ребра тетраэдра. Для этих контактов ученые подбирали стабилизирующую последовательность аминокислот и с помощью Rosetta оценивали энергию получившихся комплексов. Наиболее стабильные (с минимальной энергией) конструкции они проверили экспериментально. Оказалось, что разработанные белки самостоятельно собираются в тетраэдрические комплексы in vitro.
рисунок Васили Сулеймановой по [68]
Мы уже обсудили, что разработанные белковые многогранники ученые использовали для создания вакцины (рис. 18) [67]. Кроме того, они научились помещать внутрь таких каркасов другие молекулы. Если в таких геометрических конструкциях расположить флуоресцентные белки, то получатся очень яркие светящиеся метки. Это полезно для многих экспериментальных методов. Но гораздо интереснее использовать такие комплексы для таргетной доставки лекарств. Если комплекс будет разваливаться, как только обнаружит «больную» клетку, то достаточно просто поместить внутрь терапевтические молекулы. Они смогут выбраться из белкового укрытия только рядом с клетками-мишенями, а значит, не смогут навредить другим клеткам. Это поможет предотвратить многие возможные побочные эффекты.
Для создания подобной технологии необходимы белки, которые контролируемо меняют свою структуру при определенных параметрах окружающей среды. Ученые из Института белкового дизайна занялись и этой проблемой.
Белки-менеджеры
В живых клетках белки постоянно общаются друг с другом как раз за счет изменения своей формы. Почему мы чувствуем себя бодрее, когда выпьем кофе? Подробно об этом можно прочитать в статье «Биомолекулы» «Аденозиновые рецепторы: история великого обмана» [73]. А здесь мы приведем упрощенное объяснение: белки на поверхности клетки связываются с кофеином, меняют свою структуру и, в результате, клетка продолжает активно работать, хотя уже должна была снизить свою активность.
Обнаружение и связывание малых молекул называется рецепцией. Изменение конформации рецептора запускает передачу сигнала вглубь клетки — белки, которые непосредственно связывались с рецептором, больше не могут этого сделать, а значит, их упаковка тоже меняется. Подобные изменения последовательно затрагивают многие белки и влияют на поведение клетки — вызывают клеточный ответ.
Белки, способные общаться друг с другом за счет изменения структуры, имеют одну неотъемлемую характеристику: у них два локальных минимума энергии. В отсутствии сигнала (другой молекулы), белок находится в первом локальном минимуме, при появлении сигнала переходит во второй. Барьер, разделяющий два этих состояния, должен быть не слишком высоким, иначе изменения структуры будут невозможны.
В предыдущих проектах ученые из группы Бейкера создавали молекулы с одной стабильной структурой — у них был один локальный минимум. Дизайн белка, способного изменять конформацию в ответ на сигнал, стал для них новым вызовом. Они начали с системы «замок—защелка—ключ» (рис. 19) [74]. Замок — большой базовый белок — мог связываться одновременно с двумя маленькими пептидами: защелкой и ключом. Защелка была генетически сшита с замком длинной петлей и взаимодействовала с базовым белком слабее ключа. Поэтому как только в среде появлялась сигнальная молекула — ключ, — конформация менялась: ключ связывался с замком (рис. 19).
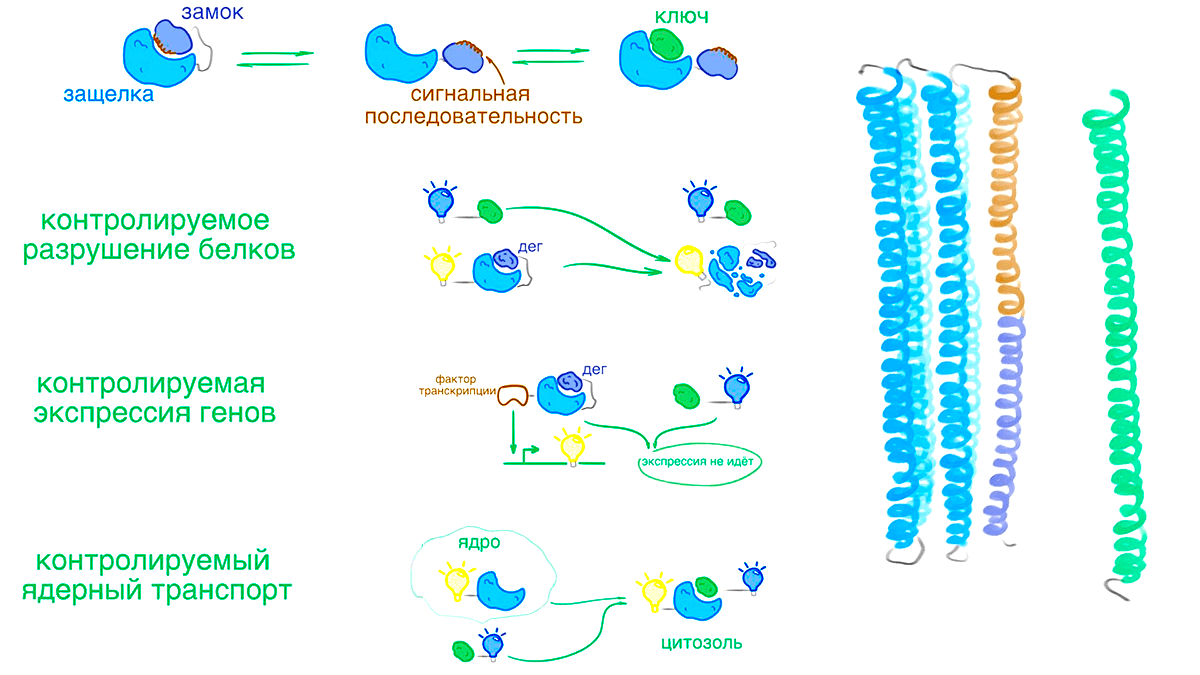
Рисунок 19. Дизайн сигнальной системы «замок—защелка—ключ». Ученые из группы Бейкера разработали белковый комплекс, способный менять структуру. Замок — белок, состоящий из пяти параллельных ɑ-спиралей, — связывался с односпиральной защелкой, с которой был соединен гибкой петлей. При появлении в среде ключа — другой ɑ-спирали — защелка отсоединялась от замка, и ее место занимал ключ.
Связывание ɑ-спиралей с замком определялось гидрофобными взаимодействиями. Это позволило легко управлять конформациями: ключ ученые сделали длиннее защелки, он связывался с замком сильнее и когда появлялся в среде, защелке приходилось уступить свое место.
Ученые пошли дальше и спрятали в защелку короткую сигнальную последовательность дегрон. Если клетка видит белок с дегроном, она его уничтожает. В закрытом состоянии дегрон был спрятан, но когда в системе появлялся ключ, защелка освобождалась, дегрон становился видимым, и клеточные машины уничтожали замок. Чтобы проверить, будет ли всё работать в клетках именно так, ученые соединили ключ и замок с флуоресцентными белками разного цвета. Когда ключа не было, клетка светилась одним цветом, но при его появлении спектр излучения менялся, сигнализируя о том, что замок уничтожается вместе со связанной с ним флуоресцентной меткой.
Исследователи использовали систему с дегроном для контроля экспрессии генов. Они связали замок с фактором транскрипции гена, который кодировал желтый флуоресцентный белок (YFP). Без ключа клетка активно светила желтым — фактор транскрипции делал свое дело. Но при появлении сигнала спектр излучения менялся — YFP больше не производился.
Ученые попробовали спрятать в защелке и другую сигнальную последовательность — nes. Она сообщает клеточным машинам, что белок необходимо перенести из ядра клетки в цитоплазму. В отсутствии ключа замок находился в ядре клетки, но при появлении сигнала перемещался в цитоплазму. Ровно как и планировалось.
рисунок Васили Сулеймановой по [74]
Контроль экспрессии генов
Система «замок—защелка—ключ» эффективно работала в клетках. С ее помощью исследователи контролировали экспрессию генов и транспорт белков из ядра в цитоплазму (рис. 19). Безусловно, клетка и сама умеет управлять этими процессами. Множество сложных сигнальных путей позволяют ей производить ровно те белки, которые ей сейчас больше всего нужны. Ученые давно хотят контролировать работу клетки, и для этого пытаются влиять на передачу сигнала.
Стандартный подход такой же, как и в работе Бейкера: научить элемент сигнального пути захватывать регулятор контроля экспрессии, который изменит скорость производства белков [75]. Такой метод имеет ряд ограничений. Во-первых, отсутствует гибкость: мы можем контролировать только определенное место определенного сигнального пути. Во-вторых, клетка использует одинаковые природные регуляторы для контроля нескольких процессов. А значит, мы будем управлять не только экспрессией конкретного гена, но и чем-то еще.
Искусственная система «замок—защелка—ключ» позволит решить обе эти проблемы. Замок можно генетически сшить с абсолютно любым белком, а значит использовать в любом сигнальном пути. Кроме того, ключ точно не участвует ни в каких других процессах — он не похож ни на один природный белок. Ученые из группы Бейкера продемонстрировали, как использовать их систему для управления сложными сигнальными путями [76]. Но контроль экспрессии — только одно из возможных применений.
Биосенсоры
В другой недавней работе ученые создали биосенсоры на основе системы «замок—защелка—ключ» [77]. В этот раз в середину защелки они спрятали последовательность домена сплит-люциферазы.
Люциферазы — это класс ферментов, которые катализируют реакцию с испусканием света [78]. В этом их основное отличие от флуорофоров — у последних свет поглощается и затем переизлучается, никакой химической реакции нет. Сплит-белки — молекулы, условно «разрезанные» на две части, которые производятся отдельно друг от друга. Каждая из них сама по себе не способна сделать что-то полезное. Но если их смешать, то образованный комплекс будет выполнять функцию оригинального белка. Так вот, сплит-люцифераза — это двухдоменный фермент, излучающий свет во время химической реакции. И один из ее доменов был спрятан в защелке. Вторую часть фермента исследователи генетически сшили с ключом.
Как только ключ вытеснял защелку в разработанной системе, домены сплит-люциферазы соединялись друг с другом, и появлялось излучение. Но этого недостаточно для создания биосенсора: нужно чтобы фермент начинал работать, только если рядом с замком есть определенные молекулы.
Чтобы решить эту проблему, ученые прикрепили к концу защелки пептиды, способные соединяться с определенными белками. Мы обсуждали создание таких специфично связывающихся молекул в разделе «Лекарство от гриппа». Чтобы в отсутствии молекулы-мишени ключ не мог вытеснить защелку, исследователи дополнительно оптимизировали последовательность замка: он тоже связывался с пептидами.
Получившаяся система была идеальным биосенсором. Как только в среде появлялась молекула-мишень, она связывалась с пептидом на конце защелки, и ключ занимал ее место в замке. В этот же момент сплит-люцифераза образовывала боеспособную единицу и начинала светить, сообщая, что в среде обнаружена молекула-мишень. Ученые из Института белкового дизайна создали биосенсоры для обнаружения гриппа, коронавируса, гепатита и рецепторов Her2 [77].
Опять же, тесты для обнаружения всех этих заболеваний существовали и раньше. Но подобные белковые тесты могут оказаться дешевле нынешних. А кроме того, в случае новой пандемии разработка белкового биосенсора займет минимальное время: всё, что нужно изменить в текущем дизайне — пептид, связывающий молекулу-мишень. В случае вируса гриппа, разработка такого короткого белка заняла несколько лет, но для коронавируса — всего пару месяцев [63]. Следующие дизайны должны занять еще меньше времени, так как методология уже отлажена. Это точно поможет нам эффективнее отреагировать на распространение болезни.
Но на контроле экспрессии и биосенсорах возможности системы «замок—защелка—ключ» не заканчиваются. Ученые использовали их еще и для терапии рака.
CAR-T терапия
На поверхности клеток есть множество разных белков, комбинация которых уникальна для конкретного типа клеток. При нарушении работы набор маркеров меняется. Это помогает обнаруживать «больные» клетки и попробовать повлиять на их (и только на их!) работу. Таким образом, мы прицельно бьем по болезни и не влияем на другие жизненно важные процессы, снижая вероятность побочных эффектов. Подобный подход называется таргетной терапией и набирает популярность в современной медицине [79].
Исследователи из группы Бейкера использовали «замок—защелка—ключ» для обнаружения клеток по комбинации маркеров [80]. Они соединили замок с белком, находящим метку A, а ключ — с белком, находящим метку B. Замок соединялся с ключом, только если на клетке были сразу оба маркера, а защелка же становилась доступна для взаимодействия с другими молекулами. Исследователи использовали такую систему для создания CAR-T-клеток (рис. 20).
CAR-T-клетки — это слегка измененные T-лимфоциты человека. Они экспонируют химерный рецептор, который распознает определенную мишень снаружи клетки и активирует лимфоцит. Такие перепрограммированные T-клетки используют для борьбы с раком. Подробнее о том, как это работает, читайте в статьях «Биомолекулы» «Т-клетки — марионетки, или Как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [81] и «Клетки, которые лечат людей» [82].
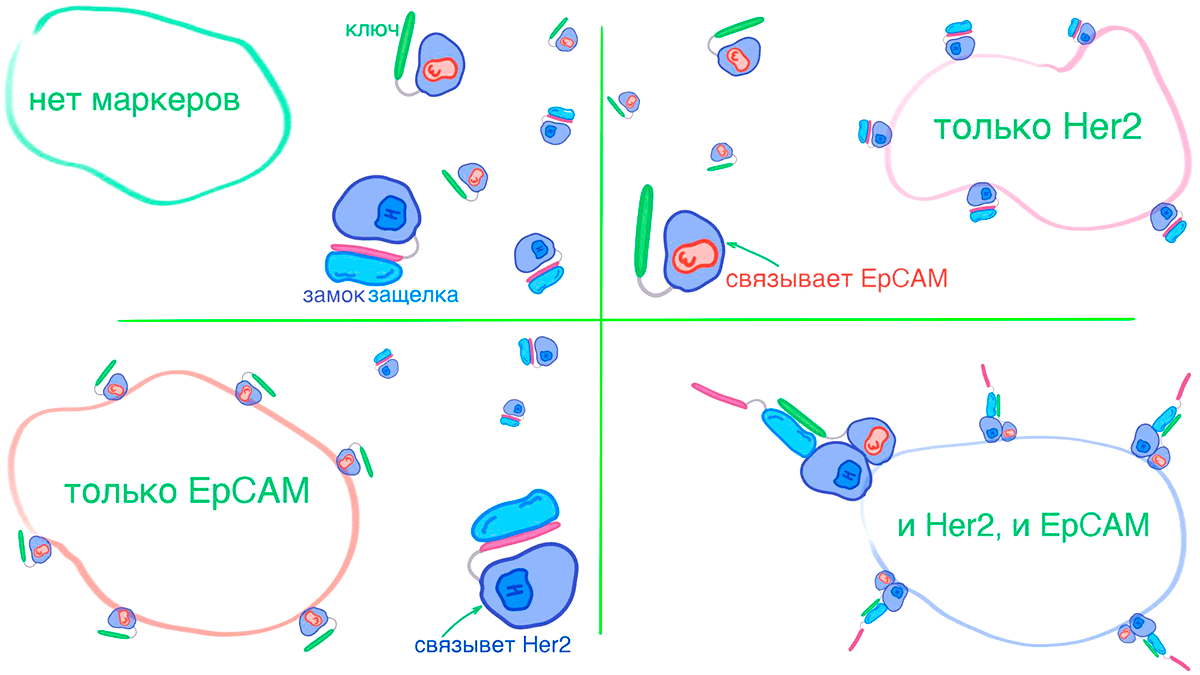
Рисунок 20. Поиск клеток по сочетанию маркеров. Исследователи из группы Бейкера адаптировали систему «замок—защелка—ключ» для обнаружения раковых клеток. Они выбрали две распространенные метки опухоли Her2/neu и EpCAM в качестве мишеней [83], [84] и создали CAR-T-клетки, способные находить только раковые клетки с обоими маркерами. Для этого они генетически сшили ключ и замок с белками, связывающими Her2 и EpCAM соответственно. В защелке закодировали последовательность, с которой связывался химерный рецептор CAR-T-клеток. Если раковая клетка производила только Her2-рецептор, то защелка всегда оставалась связанной с замком и была недоступна для CAR-T-клеток. Если же производился только EpCAM, то защелки вообще не было на поверхности клетки. Синтез сразу обеих меток активировал CAR-T-клетки, что для опухолевых клеток заканчивалось плачевно — они умирали.
рисунок Васили Сулеймановой по [80]
До использования системы «замок—защелка—ключ» в клинической практике еще очень далеко. Помимо CAR-T-клеток в организм нужно будет вводить эти искусственные белки. Как они себя поведут — большой вопрос! Смогут ли они добраться до опухоли? Не вызовут ли они иммунный ответ? На все эти вопросы еще предстоит ответить. Другое ограничение системы: она позволяет находить клетки только по двум маркерам (максимум по трем [80]). Но что если раковую клетку можно отличить по комбинации минимум из семи меток? Понадобятся более сложные системы детектирования.
Сложная логика
Система «замок—защелка—ключ» — это элемент «И» алгебры логики: защелка передает сигнал, только если в среде одновременно есть и ключ, и замок. Для реальных применений эту логику необходимо расширить: добавить логические элементы «ИЛИ» (в среде есть или A, или B) и «НЕ» (в системе нет A). И если научиться комбинировать эти операции, то можно будет находить клетки по любому заданному сочетанию большого числа меток.
Ученые из группы Бейкера создали такие белковые логические элементы и научились их соединять [85]. Они разработали молекулы, способные объединяться в пары. Коллектив Института белкового дизайна заложил возможность мономерам связываться с несколькими другими с разной силой. Это позволило исследователям, контролируя состав мономеров в среде, получать заранее выбранные пары и создавать различные логические элементы (рис. 21).
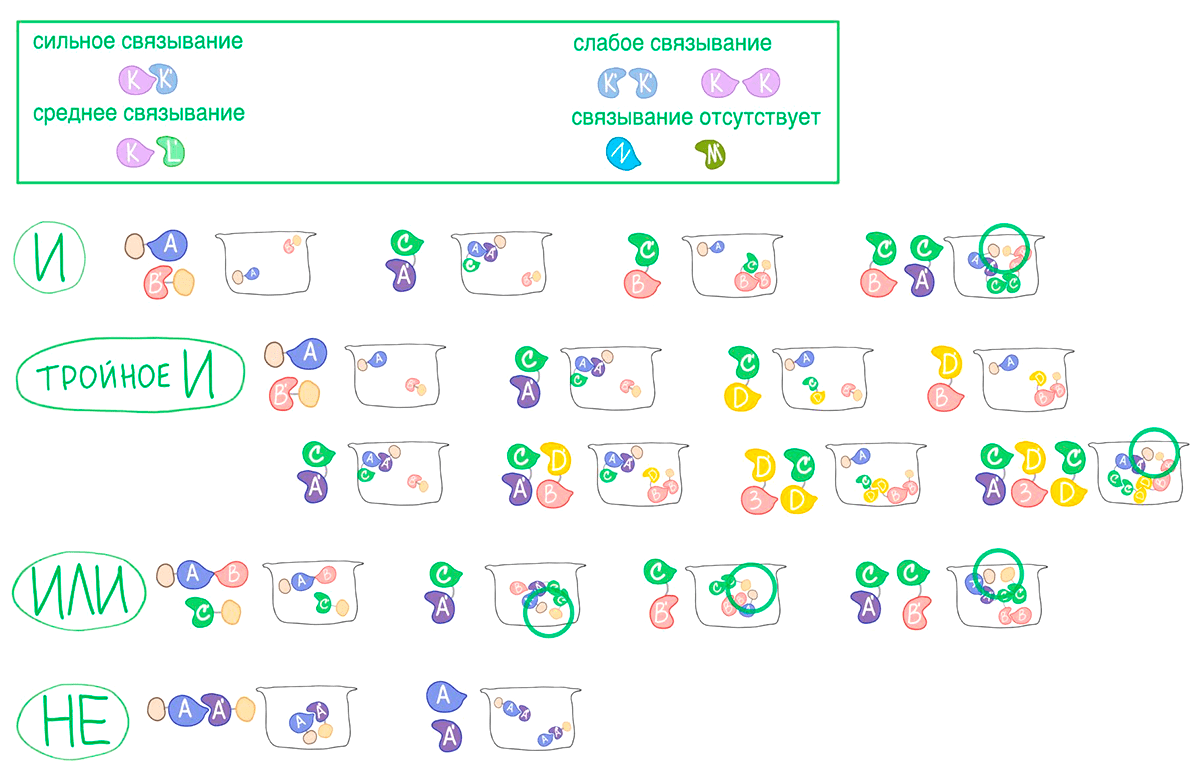
Рисунок 21. Дизайн логических элементов. Исследователи из группы Бейкера разработали логические элементы на базе белковых гетеродимеров — стабильных комплексов из двух различных молекул (K-K′). Набор таких пар мы обозначим как «оригинальные» гетеродимеры. Некоторые из разработанных мономеров могли образовывать и гомодимеры — комплекс из двух одинаковых молекул (K-K или K′-K′). Однако такие пары были гораздо менее стабильны «оригинальных» гетеродимеров. Кроме того, некоторое пары мономеров также образовывали «неоригинальные» гетеродимеры — комплексы двух мономеров из разных «оригинальных» димеров (K-L′). Такие гетеродимеры были устойчивее гомодимеров, но взаимодействовали слабее белков из «оригинальных» пар. Естественно были и мономеры, которые не взаимодействовали ни с кем, кроме своего «оригинального» партнера.
У ученых в руках оказался уникальный набор белков, которые могли объединяться в комплексы разной стабильности. Изменение белкового состава среды мгновенно приводило к изменению набора взаимодействий. Это важнейшее условия для передачи сигнала. А разнообразие существующих димеров позволит создавать куда более сложные логические элементы, чем система «замок—защелка—ключ», а значит, и более селективно выбирать клетки, на которые мы хотим повлиять.
Используя разработанную библиотеку белков, ученые создали логические элементы «И» (для позитивного ответа в системе должно одновременно быть два сигнала), «Тройное И» (нужно три сигнала), «ИЛИ» (нужен любой из двух сигналов) и «НЕ» (не должно быть данного сигнала).
Давайте подробнее разберемся с дизайном логических элементов на примере операции «И». Ученые из группы Бейкера взяли три «оригинальные» пары белков: A-A′, B-B′ и C-C′. Пары A′-B и B′-C образовывали «неоригинальные» гетеродимеры. Ученые дополнительно соединили белки A′ с B и B′ с C гибкими петлями, чтобы они не уплывали друг от друга в растворе. В результате получились комплексы A′B и B′C. Если к A′B добавить белок A, то образуется более стабильная «оригинальная» пара A′-A, а молекула B будет плавать неподалеку от этого комплекса на петле. Аналогичная картина будет, если смешать B′C с белком C′: B′ будет плавать на привязи вокруг димера C-C′. А вот если смешать A′B c B′C, то вокруг комплекса B-B′ будут плавать на петлях сразу две молекулы — A′ и C.
Ученые соединили белок A с доменом активации фактора транскрипции Gal4, а C′ с ДНК-связывающим доменом Gal4. Для начала экспрессии эти домены должны оказаться рядом. Но так как белки A и C′ не взаимодействовали, то и транскрипция не начиналась. И только когда ученые добавили в систему оба комплекса, A′B и B′C, экспрессия началась. Одновременно образовалось сразу три пары «оригинальных» димеров — A-A′, B-B′ и C-C′, — которые к тому же были соединены петлями друг с другом. Этот комплекс притянул домены фактора транскрипции друг к другу, что и запустило производство белков.
рисунок Васили Сулеймановой по [85]
Ученые из группы Бейкера предложили использовать созданные логические элементы для увеличения эффективности T-клеточной терапии. Оказывается, искусственные T-клетки активно «устают» и начинают хуже делиться и активнее умирать [86]. Один из генов, отвечающих за этот процесс, — TIM3, или HAVcr, и исследователи использовали разработанные логические элементы для контроля экспрессии этого гена [85]. Возможно, такая технология поможет контролировать процесс «уставания» T-клеток.
Коллектив института дизайна белков создал искусственные сигнальные системы и сделал первые шаги в сторону практических применений. Компания Amgen, разработавшая аналог CAR-T-терапии — терапию BiTE, — воодушевилась исследованиями Бейкера и недавно объявила о сотрудничестве с Институтом белкового дизайна. Коллаборация направлена на увеличение эффективности T-клеточной терапии с помощью белкового дизайна. А значит, нас ждут новые исследования, которые ответят на вопрос о возможности использования искусственных логических элементов в живых организмах, и, надеюсь, новые методы лечения рака.
Что дальше?
Этот вопрос волнует и самого Дэвида Бейкера. В своем выступлении на конференции TED он обозначил пять целей на ближайшее будущее:
- Универсальные вакцины от гриппа, ВИЧ и рака.
- Лекарства на базе пептидов против нейродегенеративных заболеваний и хронических болей.
- Таргетная доставка лекарств.
- «Умные» лекарства, которые находят только «больные» клетки.
- Упорядоченные материалы на основе белков.
Наработки института дизайна белков по первым четырем проблемам мы уже обсудили. Безусловно, потребуется еще много времени, вычислений и экспериментов, прежде чем эти мечты станут явью. Но ни одна из этих задач уже не выглядит научной фантастикой. Успех коллектива Бейкера с вакциной от респираторно-синцитиального вируса, первая попытка дизайна пептидов против образования амилоидных фибрилл, создание многогранников и логических элементов из белков — всё это убеждает, что через 10–20 лет наши взаимоотношения с гриппом, раком и болезнью Альцгеймера могут сильно измениться. Мы, скорее всего, перестанем так уж сильно бояться этих болезней. Ну а что с пятым пунктом? Есть ли наработки у Бейкера в этом направлении? Конечно!
Давайте сначала разберемся, что такое упорядоченные материалы и зачем они нужны. Самый простой пример — S-слои, встречающиеся у большинства бактерий. Поверхностные белки бактерий взаимодействуют друг с другом и образуют двумерные кристаллы. S-слои выполняют огромное количество разных функций: от базовой защитной до вирулентности — такие упорядоченные структуры делают бактериальную инфекцию более опасной [87]. Еще одно интересное свойство ученые обнаружили у цианобактерий: их наличие в пресных водоемах приводило к образованию гипса и кальцита [88]. Виновными естественно сделали S-слои — они предоставляли идеально упорядоченную основу для начала кристаллизации.
Исследователи из Института белкового дизайна создали искусственные самособирающиеся двумерные упорядоченные слои (рис. 22) [89]. С их помощью они усилили сигнал, передающийся в клетку. Ученые активировали путь, приводящий к росту актиновых филаментов. Когда они добавляли в среду лиганды, запускающие передачу сигнала, эти лиганды связывались с клеткой в разных местах. Актиновые нити начинали образовываться, но достаточно медленно.
Когда же ученые соединили лиганды с белками, которые самопроизвольно соединялись в двумерные слои, то они получили упорядоченный паттерн сигналов. Оказавшись на поверхности клетки, лиганды «притягивали» рецепторы актинового пути друг к другу, заставляя их таким образом упорядочиваться. В итоге, такая локализация сигнальных путей привела к существенному ускорению роста актиновых нитей.
Почему так? На ум приходит весьма жизненная аналогия: когда мы случайно роняем себе на ногу телефон, который весит всего 200 граммов, то нам может быть очень больно, особенно если он упадет ребром; но одновременно мы всю ночь приятно спим под одеялом, которое весит около 2 килограммов. Давление одеяла распределяется по всему телу, и мы практически не замечаем его веса. Телефон же всей своей массой, хоть и маленькой, ударит нас в одну точку — вот нам и больно. Такая же логика работает и для клетки: локализация сигнала существенно усиливает эффект.

Рисунок 22. Двумерные белковые материалы. Ученые разработали два белка, которые соединялись друг с другом и образовывали двумерную гексагональную плоскую решетку. Структуры кристаллических слоев, полученные с помощью электронной микроскопии, полностью соответствовали созданным дизайнам.
Какие еще применения, кроме усиления сигналов, есть у подобных двумерных наноматериалов? Как утверждает сам Дэвид Бейкер, с помощью упорядоченных плоских слоев можно увеличить эффективность солнечных батарей. Мне не удалось найти ни одного примера успешного использования именно белковых структур для этих целей, а вот ДНК-оригами — технология, позволяющая создавать упорядоченные паттерны нуклеиновых кислот, — горячая тема в солнечной энергетике [90]. Белковые кристаллические слои не сильно отличаются от рисунков ДНК-оригами, так что, скорее всего, солнечные элементы на аминокислотной основе очень даже реальны. Уж точно не менее реальны, чем универсальные вакцины, пептидная терапия, таргетная доставка и «умные» лекарства.
Но лично мне кажется, что все эти пять проектов, обозначенных Бейкером, — лишь первые шаги большого пути синтетической биологии на базе белков. Я верю, что с помощью методов белкового дизайна в ближайшие 50 лет можно будет решить три глобальные проблемы:
- Документируемая работа клетки. Работа за компьютером очень удобна по многим причинам. Одна из них — наличие лог-файлов, в которых записано абсолютно всё, что происходит с машиной. Если какая-то программа перестала работать как надо, мы всегда знаем, где искать ответ на вопрос «Почему?».
В мокрой биологии это совсем не так. Иногда клетки по непонятной причине не делают того, что от них ожидают. А на следующий день всё снова в порядке. Было бы здорово довести предсказуемость экспериментов с клетками до уровня компьютеров, но реально ли это?
Я уверен, что да. Не так давно ученые уже использовали прокариотический иммунитет CRISPR-Cas для создания лог-файлов клеток [91]. Они научили клетки добавлять короткие участки к своей ДНК в ответ на определенный сигнал: чем чаще что-то в клетке происходит, тем больше записей будет в ДНК. Чтобы «прочитать» историю клетки, нужно просто секвенировать ее ДНК. Но для этого клетку придется убить. Я верю, что дизайн белков позволит следить за клеткой в реальном времени!
Подробнее о CRISPR-Cas читайте в статье «Биомолекулы» «CRISPR-системы: иммунизация прокариот» [92].
Мы уже обсуждали, как разработки группы Бейкера помогают контролировать синтез белков. Но этот же процесс можно обернуть и вспять: создать системы «замок—защелка—ключ», которые будут активироваться только при производстве определенных молекул. Если в защелке закодировать последовательность дегрона, а замок и ключ сшить с флуоресцентными белками всевозможных цветов, — а такие можно создавать с помощью методов, описанных в разделе «Светящиеся белки на заказ», — то спектр излучения будет в реальном времени сообщать нам, какие процессы сейчас идут в клетке. Я уверен, что подобная технология реальна, хоть и очень сложна.
- Идеальная диета без усилий. Лекарство от целиакии, которое мы обсуждали в разделе «Улучшение белков» — шаг в этом направлении. Но можно сделать куда больше! Говорят, что переработанное мясо вредно? Не беда! Давайте сделаем белки, которые будут захватывать все потенциально опасные молекулы гамбургера, и посещать McDonalds или вашу любимую бургерную станет безопасно для здоровья.
Дизайн белков поможет справиться и с несбалансированным питанием! Лишний сахар можно связать, а недостаток витаминов помогут восполнить белковые многогранники, таргетно доставляющие витамины в нужные части организма. Мы наконец-то сможем есть всё, что хотим, не боясь за свое здоровье. Нужно будет лишь время от времени пополнять запас искусственных белков в нашем организме.
- Доктор внутри нас. Но зачем останавливаться на диете? Представьте себе белкового доктора прямо внутри вашего организма. Множество крупных молекулярных комплексов постоянно находятся внутри нас и ищут нарушения в работе наших клеток. Обнаружив их, они моментально принимают меры и исправляют найденные проблемы. По сути, вы каждую секунду сдаете анализ крови и делаете биопсию всех участков вашего тела. Каждая маленькая проблема моментально получает должное лечение, и серьезные заболевания просто не развиваются.
Конечно, это не станет панацеей от всех болезней, но поможет взять многие распространенные заболевания под контроль. Придется создать тысячи белков, которые будут стабильно работать по заданному сценарию, но такие искусственные комплексы помогут спасти тысячи жизней. Я надеюсь, что на горизонте пятидесяти лет решение подобных задач станет реальностью.
Как мы обсудили, исследования в направлении протоколирования работы клеток уже идут, как и работа по другим двум направлениям. Наномашины, помогающие нашему телу эффективнее выполнять свои функции, создают из разных материалов и они уже помогают лучше чистить зубы, вовремя принимать лекарства и даже бороться с мужским бесплодием. Вы можете подробнее узнать об успехах нанотехнологий в статье «Биомолекулы» «Нанотехнологии — новый союзник в войне с болезнями» [93]. Однако несмотря на все успехи, я верю, что именно материалы на белковой основе помогут достичь озвученных целей. Почему?
Вся проблема в нашем иммунитете. Он слишком бурно реагирует на появление в организме чужеродных частиц. Это, естественно, относится и к белкам, но в группе Бейкера учатся с этим бороться. Ученые экспериментально определяют, на какие эпитопы возникает иммунный ответ, и меняют последовательности этих участков [94]. Естественно, небелковые наноматериалы тоже можно сделать безопасными для человека. Например, если покрыть их поверхность биосовместимыми молекулами, то иммунитет ничего не заметит. Но мне кажется, что это слишком сложные и громоздкие конструкции. А как говорил (на самом деле он сказал куда более сложную фразу) Альберт Эйнтштейн: «Всё нужно упрощать до предела, но не более того». Поэтому я ставлю на белковые наноматериалы!
А если точнее, я ставлю на коллектив Института белкового дизайна. Они не просто создали классную программу Rosetta, но и придумали, как ее применить. Даже постановка задач для некоторых исследований вызывает у меня восхищение. Создание белковых вакцин — да, звучит логично. Но когда я читал статьи Бейкера про многогранники, мне приходили в голову мысли про таргетную доставку лекарств, но никак не про вакцины. Возможно, вам эта идея пришла в голову сразу и показалась банальной, но я уверен, что хотя бы один из проектов Института белкового дизайна заставил вас задаться вопросом «да как они такое вообще придумали?» Так что я бы в очередной раз хотел подчеркнуть, что секретом успеха Rosetta стали именно люди, которые использовали эту программу для реализации своих идей. Rosetta была лишь инструментом в руках мастеров.
В конце, хотелось бы также отметить, что «сухой» дизайн, это лишь первый шаг любого проекта в Институте, возглавляемом Бейкером. Функциональность всех созданных белков тщательно проверяется всевозможными экспериментальными методами. Компьютерное моделирование лишь подсказывает направление: какие белки стоит попробовать, а какие нет. Но дальше уже измерения подсказывают, как улучшить предложенные дизайны. Rosetta без всяких сомнений отличный помощник, но без экспериментальной базы создавать новые белки невозможно.
Группа Бейкера продолжает активно менять наши представления о том, что могут делать искусственные белки. На базе своих исследований коллектив основал 11 стартапов, 5 из которых активны и сейчас. Многие разработки уже запатентованы, некоторые должны скоро появиться на рынке. Чего нам ждать от Института белкового дизайна дальше? Будут ли реализованы те амбициозные идеи, которые озвучил сам Дэвид Бейкер? Смогут ли ученые приблизиться к созданию лог-файлов для клеток или белков, контролирующих наше питание и здоровье? Я очень на это надеюсь. Ну а пока, я буду с нетерпением ждать новых замечательных работ из Института белкового дизайна!
Литература
- 12 методов в картинках: структурная биология;
- Проблема фолдинга белка;
- Роль слабых взаимодействий в биополимерах;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- Торжество компьютерных методов: предсказание строения белков;
- Физическая водобоязнь;
- P. Wolynes, J. Onuchic, D. Thirumalai. (1995). Navigating the folding routes. Science. 267, 1619-1620;
- 12 методов в картинках: «сухая» биология;
- Дизайнерские ферменты на службе общества;
- Новые успехи в предсказании пространственной структуры белков;
- AlphaFold: нейросеть для предсказания структуры белков от британских ученых;
- Непохожие «гомологичные» белки;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Jogalekar A. (2013). Computational chemistry wins 2013 Nobel Prize in Chemistry. Scientific American;
- «Виртуальная» Нобелевская премия по химии (2013);
- K. Lindorff-Larsen, S. Piana, R. O. Dror, D. E. Shaw. (2011). How Fast-Folding Proteins Fold. Science. 334, 517-520;
- P. Bradley. (2005). Toward High-Resolution de Novo Structure Prediction for Small Proteins. Science. 309, 1868-1871;
- Christopher Bystroff, Kim T Simons, Karen F Han, David Baker. (1996). Local sequence-structure correlations in proteins. Current Opinion in Biotechnology. 7, 417-421;
- R. Chanhrasekaran, G. N. Ramachandran. (2009). STUDIES ON THE CONFORMATION OF AMINO ACIDS. International Journal of Protein Research. 2, 223-233;
- Alexander D. Scouras, Valerie Daggett. (2011). The dynameomics rotamer library: Amino acid side chain conformations and dynamics from comprehensive molecular dynamics simulations in water. Protein Science. 20, 341-352;
- Carol A. Rohl, Charlie E.M. Strauss, Kira M.S. Misura, David Baker. (2004). Protein Structure Prediction Using Rosetta. Methods in Enzymology. 66-93;
- Stefano Piana, Paul Robustelli, Dazhi Tan, Songela Chen, David E. Shaw. (2020). Development of a Force Field for the Simulation of Single-Chain Proteins and Protein–Protein Complexes. J. Chem. Theory Comput.. 16, 2494-2507;
- Jordan Chapman, Ahmed Ismail, Cerasela Dinu. (2018). Industrial Applications of Enzymes: Recent Advances, Techniques, and Outlooks. Catalysts. 8, 238;
- Federica Rigoldi, Stefano Donini, Alberto Redaelli, Emilio Parisini, Alfonso Gautieri. (2018). Review: Engineering of thermostable enzymes for industrial applications. APL Bioengineering. 2, 011501;
- A. Korkegian. (2005). Computational Thermostabilization of an Enzyme. Science. 308, 857-860;
- Sydney R. Gordon, Elizabeth J. Stanley, Sarah Wolf, Angus Toland, Sean J. Wu, et. al.. (2012). Computational Design of an α-Gliadin Peptidase. J. Am. Chem. Soc.. 134, 20513-20520;
- Clancey Wolf, Justin B. Siegel, Christine Tinberg, Alessandra Camarca, Carmen Gianfrani, et. al.. (2015). Engineering of Kuma030: A Gliadin Peptidase That Rapidly Degrades Immunogenic Gliadin Peptides in Gastric Conditions. J. Am. Chem. Soc.. 137, 13106-13113;
- Липидный фундамент жизни;
- Brian Kuhlman, Gautam Dantas, Gregory C. Ireton, Gabriele Varani, Barry L. Stoddard, David Baker. (2003). Design of a Novel Globular Protein Fold with Atomic-Level Accuracy. Science. 302, 1364-1368;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- Christine E. Tinberg, Sagar D. Khare, Jiayi Dou, Lindsey Doyle, Jorgen W. Nelson, et. al.. (2013). Computational design of ligand-binding proteins with high affinity and selectivity. Nature. 501, 212-216;
- Alexandre Zanghellini, Lin Jiang, Andrew M. Wollacott, Gong Cheng, Jens Meiler, et. al.. (2006). New algorithms and an in silico benchmark for computational enzyme design. Protein Sci.. 15, 2785-2794;
- Три поколения лекарств;
- David J. Craik, David P. Fairlie, Spiros Liras, David Price. (2013). The Future of Peptide-based Drugs. Chemical Biology & Drug Design. 81, 136-147;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Miriam Góngora-Benítez, Judit Tulla-Puche, Fernando Albericio. (2014). Multifaceted Roles of Disulfide Bonds. Peptides as Therapeutics. Chem. Rev.. 114, 901-926;
- Alessandro Zorzi, Kaycie Deyle, Christian Heinis. (2017). Cyclic peptide therapeutics: past, present and future. Current Opinion in Chemical Biology. 38, 24-29;
- Gaurav Bhardwaj, Vikram Khipple Mulligan, Christopher D. Bahl, Jason M. Gilmore, Peta J. Harvey, et. al.. (2016). Accurate de novo design of hyperstable constrained peptides. Nature. 538, 329-335;
- Parisa Hosseinzadeh, Gaurav Bhardwaj, Vikram Khipple Mulligan, Matthew D. Shortridge, Timothy W. Craven, et. al.. (2017). Comprehensive computational design of ordered peptide macrocycles. Science. 358, 1461-1466;
- Daniel J Mandell, Evangelos A Coutsias, Tanja Kortemme. (2009). Sub-angstrom accuracy in protein loop reconstruction by robotics-inspired conformational sampling. Nat Methods. 6, 551-552;
- Stuart A. Sievers, John Karanicolas, Howard W. Chang, Anni Zhao, Lin Jiang, et. al.. (2011). Structure-based design of non-natural amino-acid inhibitors of amyloid fibril formation. Nature. 475, 96-100;
- Dennis J Selkoe, John Hardy. (2016). The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO Mol Med. 8, 595-608;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- 12 методов в картинках: иммунологические технологии;
- Теоретическая химия: от молекулы водорода до структуры белков;
- Florian Richter, Andrew Leaver-Fay, Sagar D. Khare, Sinisa Bjelic, David Baker. (2011). De Novo Enzyme Design Using Rosetta3. PLoS ONE. 6, e19230;
- J. B. Siegel, A. Zanghellini, H. M. Lovick, G. Kiss, A. R. Lambert, et. al.. (2010). Computational Design of an Enzyme Catalyst for a Stereoselective Bimolecular Diels-Alder Reaction. Science. 329, 309-313;
- Daniela Röthlisberger, Olga Khersonsky, Andrew M. Wollacott, Lin Jiang, Jason DeChancie, et. al.. (2008). Kemp elimination catalysts by computational enzyme design. Nature. 453, 190-195;
- L. Jiang, E. A. Althoff, F. R. Clemente, L. Doyle, D. Rothlisberger, et. al.. (2008). De Novo Computational Design of Retro-Aldol Enzymes. Science. 319, 1387-1391;
- Тетрис XXI века;
- N. Preiswerk, T. Beck, J. D. Schulz, P. Milovnik, C. Mayer, et. al.. (2014). Impact of scaffold rigidity on the design and evolution of an artificial Diels-Alderase. Proceedings of the National Academy of Sciences. 111, 8013-8018;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Флуоресцирующая Нобелевская премия по химии;
- J. S. Richardson, D. C. Richardson. (2002). Natural -sheet proteins use negative design to avoid edge-to-edge aggregation. Proceedings of the National Academy of Sciences. 99, 2754-2759;
- Jiayi Dou, Anastassia A. Vorobieva, William Sheffler, Lindsey A. Doyle, Hahnbeom Park, et. al.. (2018). De novo design of a fluorescence-activating β-barrel. Nature. 561, 485-491;
- Po-Ssu Huang, Gustav Oberdorfer, Chunfu Xu, Xue Y. Pei, Brent L. Nannenga, et. al.. (2014). High thermodynamic stability of parametrically designed helical bundles. Science. 346, 481-485;
- «Костыль» для нейраминидазы;
- Неуловимый грипп;
- S. J. Fleishman, T. A. Whitehead, D. C. Ekiert, C. Dreyfus, J. E. Corn, et. al.. (2011). Computational Design of Proteins Targeting the Conserved Stem Region of Influenza Hemagglutinin. Science. 332, 816-821;
- Eva-Maria Strauch, Steffen M Bernard, David La, Alan J Bohn, Peter S Lee, et. al.. (2017). Computational design of trimeric influenza-neutralizing proteins targeting the hemagglutinin receptor binding site. Nat Biotechnol. 35, 667-671;
- Merika Treants Koday, Jorgen Nelson, Aaron Chevalier, Michael Koday, Hannah Kalinoski, et. al.. (2016). A Computationally Designed Hemagglutinin Stem-Binding Protein Provides In Vivo Protection from Influenza Independent of a Host Immune Response. PLoS Pathog. 12, e1005409;
- Longxing Cao, Inna Goreshnik, Brian Coventry, James Brett Case, Lauren Miller, et. al.. (2020). De novo design of picomolar SARS-CoV-2 miniprotein inhibitors. Science. 370, 426-431;
- Daniel-Adriano Silva, Shawn Yu, Umut Y. Ulge, Jamie B. Spangler, Kevin M. Jude, et. al.. (2019). De novo design of potent and selective mimics of IL-2 and IL-15. Nature. 565, 186-191;
- Разработка вакцин: чем и как имитировать болезнь?;
- Martin F. Bachmann, Gary T. Jennings. (2010). Vaccine delivery: a matter of size, geometry, kinetics and molecular patterns. Nat Rev Immunol. 10, 787-796;
- Jessica Marcandalli, Brooke Fiala, Sebastian Ols, Michela Perotti, Willem de van der Schueren, et. al.. (2019). Induction of Potent Neutralizing Antibody Responses by a Designed Protein Nanoparticle Vaccine for Respiratory Syncytial Virus. Cell. 176, 1420-1431.e17;
- N. P. King, W. Sheffler, M. R. Sawaya, B. S. Vollmar, J. P. Sumida, et. al.. (2012). Computational Design of Self-Assembling Protein Nanomaterials with Atomic Level Accuracy. Science. 336, 1171-1174;
- Yang Hsia, Jacob B. Bale, Shane Gonen, Dan Shi, William Sheffler, et. al.. (2016). Design of a hyperstable 60-subunit protein icosahedron. Nature. 535, 136-139;
- J. B. Bale, S. Gonen, Y. Liu, W. Sheffler, D. Ellis, et. al.. (2016). Accurate design of megadalton-scale two-component icosahedral protein complexes. Science. 353, 389-394;
- Neil P. King, Jacob B. Bale, William Sheffler, Dan E. McNamara, Shane Gonen, et. al.. (2014). Accurate design of co-assembling multi-component protein nanomaterials. Nature. 510, 103-108;
- ДНК-оригами: путь от гравюры до нанороботов длиной в 30 лет;
- Аденозиновые рецепторы: история великого обмана;
- Robert A. Langan, Scott E. Boyken, Andrew H. Ng, Jennifer A. Samson, Galen Dods, et. al.. (2019). De novo design of bioactive protein switches. Nature. 572, 205-210;
- C. J. Bashor, N. C. Helman, S. Yan, W. A. Lim. (2008). Using Engineered Scaffold Interactions to Reshape MAP Kinase Pathway Signaling Dynamics. Science. 319, 1539-1543;
- Andrew H. Ng, Taylor H. Nguyen, Mariana Gómez-Schiavon, Galen Dods, Robert A. Langan, et. al.. (2019). Modular and tunable biological feedback control using a de novo protein switch. Nature. 572, 265-269;
- Alfredo Quijano-Rubio, Hsien-Wei Yeh, Jooyoung Park, Hansol Lee, Robert A. Langan, et. al.. (2021). De novo design of modular and tunable protein biosensors. Nature;
- Биолюминесценция: возрождение;
- Таргетная терапия — прицельный удар по болезни;
- Marc J. Lajoie, Scott E. Boyken, Alexander I. Salter, Jilliane Bruffey, Anusha Rajan, et. al.. (2020). Designed protein logic to target cells with precise combinations of surface antigens. Science. eaba6527;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- Клетки, которые лечат людей;
- Краткая история открытия и применения антител;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Zibo Chen, Ryan D. Kibler, Andrew Hunt, Florian Busch, Jocelynn Pearl, et. al.. (2020). De novo design of protein logic gates. Science. 368, 78-84;
- E John Wherry. (2011). T cell exhaustion. Nat Immunol. 12, 492-499;
- Uwe B. Sleytr, Bernhard Schuster, Eva-Maria Egelseer, Dietmar Pum. (2014). S-layers: principles and applications. FEMS Microbiol Rev. 38, 823-864;
- J. B. Thompson, F. G. Ferris. (1990). Cyanobacterial precipitation of gypsum, calcite, and magnesite from natural alkaline lake water. Geol. 18, 995;
- Ariel J. Ben-Sasson, Joseph L. Watson, William Sheffler, Matthew Camp Johnson, Alice Bittleston, et. al.. (2021). Design of biologically active binary protein 2D materials. Nature. 589, 468-473;
- Elisa A. Hemmig, Celestino Creatore, Bettina Wünsch, Lisa Hecker, Philip Mair, et. al.. (2016). Programming Light-Harvesting Efficiency Using DNA Origami. Nano Lett.. 16, 2369-2374;
- Ravi U. Sheth, Sung Sun Yim, Felix L. Wu, Harris H. Wang. (2017). Multiplex recording of cellular events over time on CRISPR biological tape. Science. 358, 1457-1461;
- CRISPR-системы: иммунизация прокариот;
- Нанотехнологии — новый союзник в войне с болезнями;
- R. Mazor, J. A. Eberle, X. Hu, A. N. Vassall, M. Onda, et. al.. (2014). Recombinant immunotoxin for cancer treatment with low immunogenicity by identification and silencing of human T-cell epitopes. Proceedings of the National Academy of Sciences. 111, 8571-8576.