Найти и обезболить: чего мы достигли в разработке анальгетиков?
30 января 2026
Найти и обезболить: чего мы достигли в разработке анальгетиков?
- 1012
- 0
- 3
Одни лишь олды припомнят мем о Гарольде, скрывающем боль; прочих ждет боль непонимания.
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Каждому иногда бывает больно, но не каждый понимает, почему: какие физиологические механизмы стоят за этим мучительным ощущением. Боль — важный защитный сигнал организма. Что же делать, чтобы, уловив этот сигнал, перестать мучиться от уже ненужной боли? Сможет ли человечество избавиться от острой и хронической боли, сопровождающей многие заболевания? В век генной терапии и РНК-вакцин, так ли хорошо у нас обстоят дела с анальгетиками? В этой серии Спецпроекта по нейрофармакологии мы погрузимся в нейробиологию болевых ощущений и постараемся ответить на эти и многие другие вопросы о боли. Вместе с нами вы пройдете долгий и болезненный путь разработки современных анальгетиков от аспирина до моноклональных антител и нейропептидов и увидите, в какой точке мы находимся в данный момент.
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
Единственное, чего можно было желать в лицо боли, это чтобы она прекратилась. Ничего в мире не было так ужасно, как физическая боль. Перед физической болью не существует героев.
— Джордж Оруэлл, «1984».
Боль испытывал каждый читатель данной статьи, но, как ни странно, этому ощущению сложно дать четкое определение. Международная ассоциация по изучению боли (IASP) определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с реальным или потенциальным повреждением тканей». И — да, она сопровождает нас в течение всей жизни, находясь в основе инстинкта самосохранения; но что скрывать — у каждого были моменты, когда боль хотелось бы просто «выключить».
Выключение боли — это в некоторой степени мировоззренческое решение. Как правило, боль не несет непосредственной угрозы жизни и здоровью, она просто мучает. Принимая болеутоляющие, люди избавляются от страданий и... получают побочки от анальгетиков, а иногда и тяжелые зависимости.
Сама мысль, что человек не должен страдать понапрасну, кажется гуманистической, чистой идеей. Однако, как показал недавний скандал с компанией Purdue Pharma (когда в обществе вначале продвигалась идея, что любая боль ненормальна и ее нельзя терпеть, а затем — продвигался в качестве безопасного болеутоляющего опиоид оксиконтин, что привело к огромному росту наркомании) — за личиной гуманизма может скрываться всего лишь жажда наживы, а исцеление от страданий не может быть бесплатным и без последствий.
Ниже мы рассмотрим, зачем нам нужна боль, какие физиологические основы лежат за этим явлением и какие есть средства, чтобы с ней справиться, когда это необходимо.
Больная тема
Боль донимает нас, доставляя массу неудобств, а иногда превращает жизнь в настоящий кошмар. Но в некотором смысле она — наш союзник, поскольку работает своеобразной «системой оповещения» о потенциальных опасностях, которая защищает организм и обеспечивает его выживание. Например, прикосновение к чему-то горячему вызывает рефлекторное отдергивание руки даже до перцепции боли — так организм избегает серьезных ожогов.
При получении травмы боль заставляет человека меньше нагружать поврежденную часть тела. Это способствует заживлению и предотвращает дальнейшее повреждение. Есть такое выражение: «Боль — лучший учитель» (не воспринимайте как педагогическую рекомендацию). Неприятный опыт, связанный с болью, помогает организму учиться и избегать подобных ситуаций в будущем. Это формирует поведенческие паттерны, направленные на самосохранение. Кроме того, боль может быть признаком скрытого заболевания — например, онкологического, повреждения внутренних органов или инфекции. Этот сигнал побуждает обратиться за медицинской помощью, что способствует своевременному лечению. Интересно, что люди, нечувствительные к боли (врожденная анальгезия), подвержены большему риску травм и инфекций и меньше живут… Это наглядно демонстрирует, насколько важна боль для выживания в эволюционном контексте.
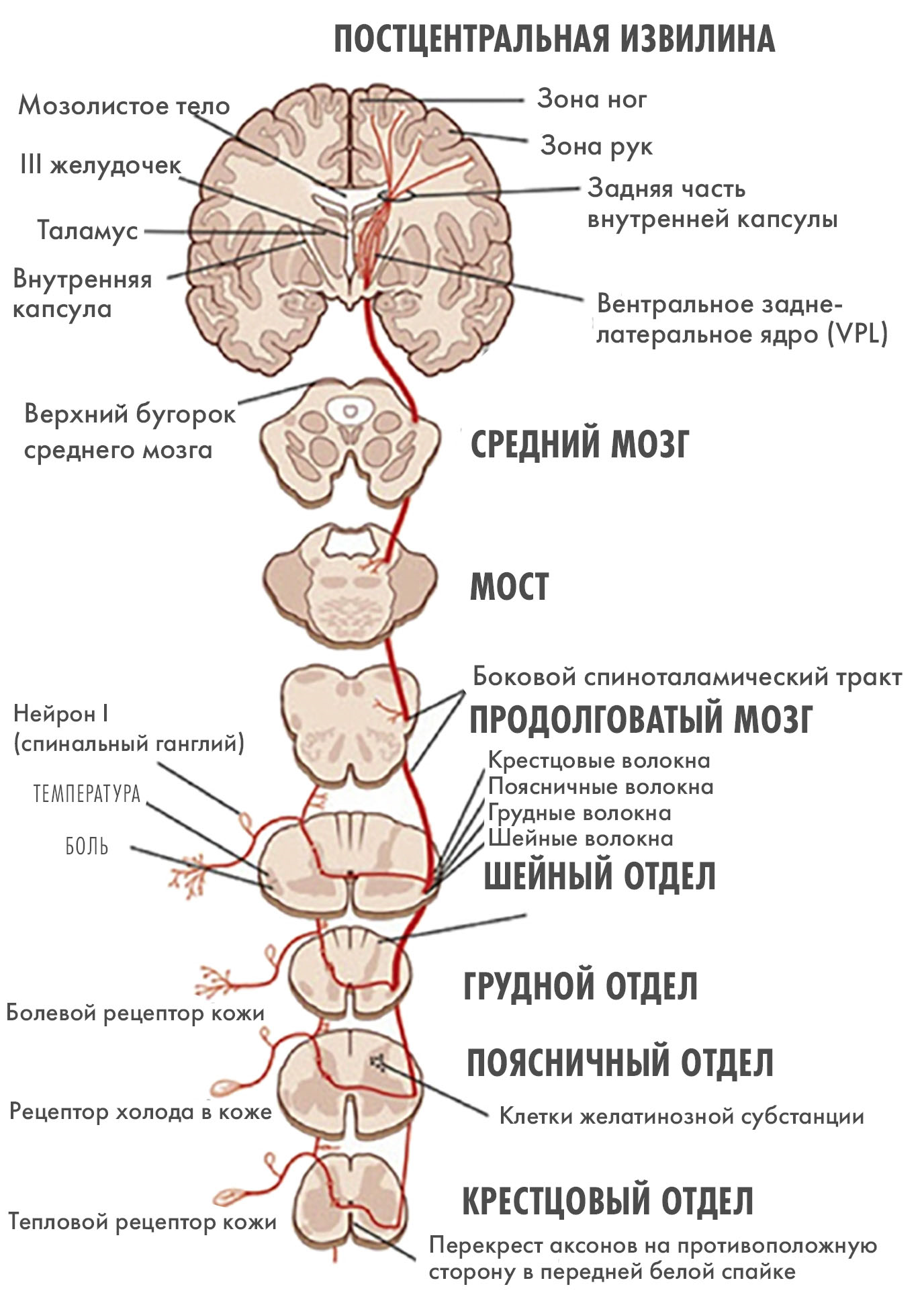
Путь, который «проходит» боль по нашему организму, принято делить на четыре этапа: трансдукцию, трансмиссию, модуляцию и восприятие. На каждой «станции» этого маршрута мы подробно остановимся в следующих разделах, а сейчас обозначим лишь общие ориентиры:
- В ходе трансдукции специализированные рецепторы боли — ноцицепторы — обнаруживают повреждающие стимулы и преобразуют их в нервные импульсы. Ноцицепторы расположены по всему телу — в коже, мышцах, внутренних органах и суставах. При повреждении ткани (например, от пореза, ожога, сильного давления) или высвобождении химических веществ (гистамина, простагландинов) ноцицепторы активируются, а это меняет трансмембранный потенциал нервных окончаний и вызывает нервный (болевой) импульс.
- В ходе трансмиссии (также ее называют кондукцией) электрические импульсы передаются в спинной мозг по специальным волокнам Aẟ и C. Aẟ-волокна отвечают за быструю, острую, локализованную боль. C-волокна передают медленную, тупую, жгучую боль, которая плохо локализуется. Импульс достигает спинного мозга, а затем по восходящим трактам (спиноталамическому и спиноретикулярному) поднимается к различным структурам головного мозга, таким как таламус, ретикулярная формация и кора больших полушарий.
- На этапе модуляции происходит изменение интенсивности болевого сигнала. Модуляция может как усиливать, так и ослаблять болевые импульсы. Этот процесс происходит в спинном и/или головном мозге. Организм может самостоятельно уменьшать боль, высвобождая внутренние обезболивающие вещества, такие как эндорфины и энкефалины, которые действуют на опиоидные рецепторы.
- Восприятие (перцепция). Это уже конечный этап, на котором человек осознает болевые ощущения. Это субъективное переживание, которое формируется в коре головного мозга, куда болевой сигнал пришел после обработки в таламусе и других подкорковых структурах. Здесь происходит интеграция болевой информации с другими факторами, такими как внимание, память, эмоциональное состояние и прошлый опыт. Именно на этом этапе боль становится осознанным и эмоционально окрашенным переживанием [1].
Какая бывает боль?
Помимо ноцицептивной боли (возникающей из-за активации ноцицепторов в ответ на объективные события из реального мира), есть и нейропатическая боль — в некотором смысле глюк нервной системы, при котором болевой сигнал возникает из-за повреждения нерва, а не после активации ноцицепторов. Например, так бывает при диабетической нейропатии или невралгии. В некоторых случаях возможна смешанная боль, при которой сочетаются ноцицептивный и нейропатический компоненты [2].
Ноцицептивную боль, в свою очередь, можно разделить на соматическую (повреждение кожи, мышц, костей и суставов) и висцеральную (повреждение внутренних органов). Висцеральная боль обычно плохо локализована (человеку трудно понять, что именно у него болит, ясно только, что что-то «внутри»), а соматическую локализовать просто.
По продолжительности боль можно разделить на острую (до 3–6 месяцев) и хроническую (более 3–6 месяцев). Острая боль, как правило, отражает какую-либо травму или заболевание и проходит с устранением причины боли, а хроническая может быть самостоятельным заболеванием.
Для определения интенсивности боли используют разные подходы. В нашей статье мы будем пользоваться шкалой, по которой можно выделить слабую, умеренную, сильную и невыносимую боль (рис. 1). Также существуют другие типы шкал: аналоговая (от 1 до 10) и шкала лиц (для детей и пациентов, которым трудно выразить словами свои ощущения).
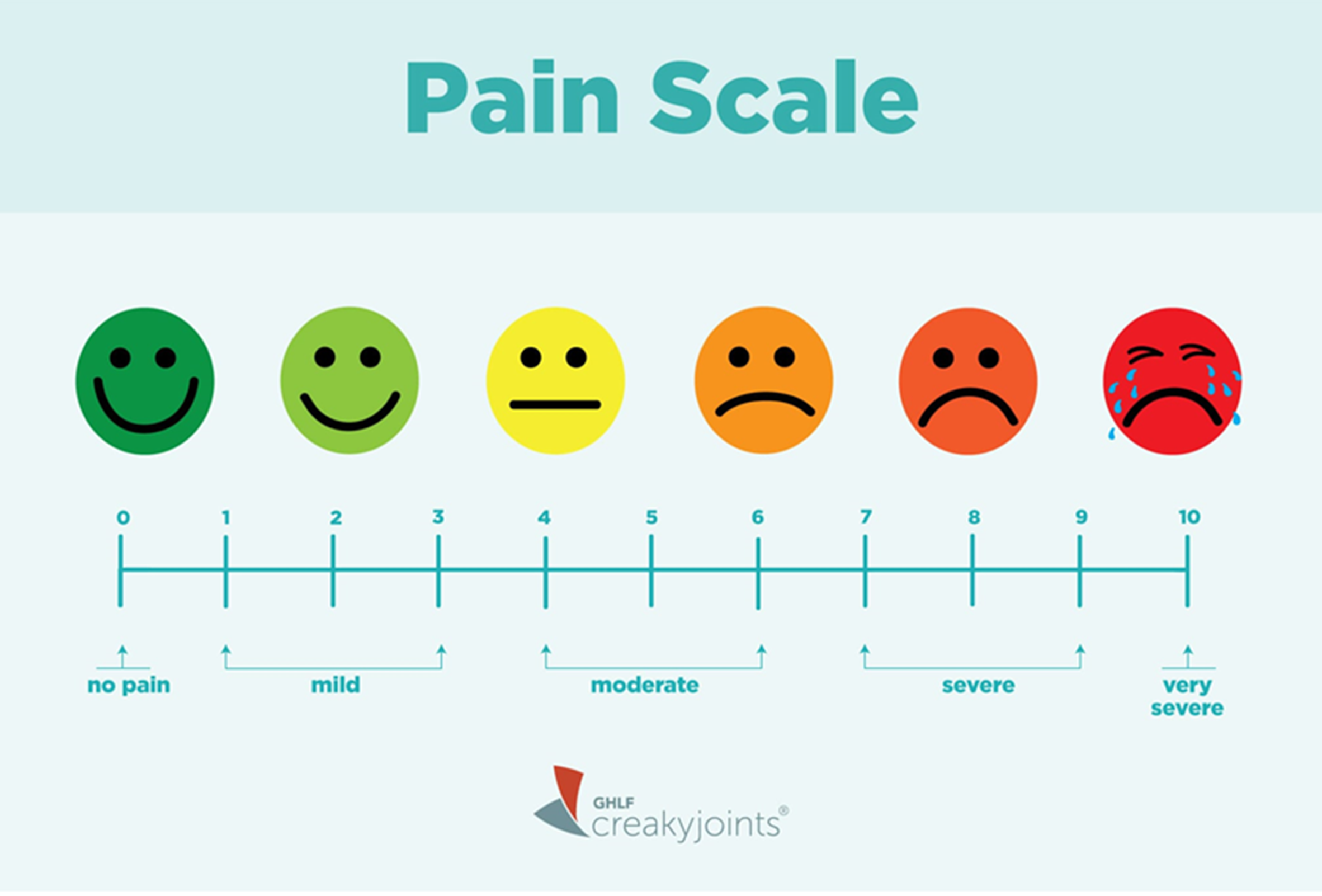
Рисунок 1. Шкалы интенсивности боли и их взаимные соответствия: шкала лиц, десятибалльная шкала и «шкала слов».
Ворота боли: трансдукция болевого сигнала
Болевой сигнал начинает свой путь по организму (трансдукцию) с активации ноцицепторов. Эти терминали берут начало из тел нейронов в ганглиях задних корешков спинного мозга или в нервном узле тройничного нерва (об анатомии наш следующий раздел); от тела клетки один аксональный отросток достигает периферии (ноцицептор), а другой проецируется в спинной мозг или ствол головного мозга [3].
- Ноцицепторы —
- относительно неспециализированные окончания нервных клеток (терминали), инициирующие процесс болевой чувствительности. Не путайте клетки-ноцицепторы с белками-рецепторами, которые находятся в мембранах нейрона.
Как правило, ноцицепторы активируются несколькими стимулами, включая воспалительные медиаторы, такие как интерлейкины, простагландины и цитокины, а также нейропатические (вызванные повреждением) и ноцицептивные (термические, химические и механические) стимулы [4].
Типы нервных волокон
Отростки чувствительных нервных клеток, передающие информацию о боли в спинной мозг, в основном представляют собой миелинизированные аксоны Aẟ и немиелинизированные C-волокна. Основные отличия между этими волокнами — типы стимулов, которые их активируют, и скорость проведения по ним нервных импульсов:
- Первый тип (Aẟ) активируется механическими и термическими стимулами и обеспечивает быструю проводимость (около 20 м/с) за счет миелинизации. Поэтому такой тип волокон определяет «первичную» боль (то, что мы чувствуем, когда мизинец ноги внезапно встречает ножку стола или кровати). Локализованы такие волокна в большей степени в поверхностных тканях — например, коже. Это около 30% от всех ноцицепторов.
- C-волокна — более медленные полимодальные ноцицепторы, которые реагируют на сильные механические, термические и химические раздражители. Низкая скорость (менее 2 м/с) вызвана отсутствием миелиновой оболочки, а потому C-волокна определяют «вторичную» боль — более продолжительную, тупую, жгучую, ноющую или диффузную. Часто встречаются в мышцах и суставах, а также во внутренних органах. Этих ноцицепторов у нас больше всего — около 70%.
- Также в ощущении боли могут участвовать другие волокна, не относящиеся к ноцицепторам, — например, Aβ. При повреждении нервов (при нейропатической боли) Aβ-волокна могут активировать ноцицептивные пути. В таких случаях обычное, безвредное прикосновение (передаваемое Aβ волокнами) воспринимается как боль, что называется аллодинией. Также существует мнение, что Aβ-волокна могут модулировать болевые ощущения по механизму «воротного контроля боли». Этот механизм объясняет, почему растирание ушибленного места может ослабить боль — быстрые неболевые сигналы, передаваемые Aβ-волокнами, могут подавлять медленные болевые сигналы от C-волокон (об этой теории подробнее в одном из следующих разделов).
Молекулярные рецепторы боли
Какие же молекулярные механизмы лежат в основе трансдукции, трансформации и модуляции болевого сигнала? Ранее «Биомолекула» уже публиковала статью о молекулярных механизмах боли [5], и если вы любите биохимию так же, как любим ее мы, то обязательно прочитайте. Здесь мы лишь кратко обозначим основные группы рецепторов, отвечающих за проведение и восприятие болевого сигнала. В этом разделе мы разберем подробно лишь некоторые рецепторы — те, которые не стали пока основой для зарегистрированных болеутоляющих препаратов. Те же, что уже «взлетели» в фармакологическом поиске, — опиоидные рецепторы и натриевые каналы — мы рассмотрим вместе с соответствующими лекарствами, поскольку действие лекарства неразрывно связано со структурой рецептора, в которое оно метит.
TRP-рецепторы —
это семейство ионных каналов, играющих ключевую роль в ощущении боли (а название их происходит от Transient Receptor Potential). Они воспринимают термические, химические и механические стимулы, то есть в большей степени характерны для полимодальных C-ноцицепторов. Семейство TRP весьма разнообразно и любимо биохимиками — см., например, «Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021)» [6], а также наш мини-комикс на рис. 2. Подробности о самых «теплых» и «холодных» представителях этой группы белков, а также на что еще, кроме температуры, они реагируют, смотрите на рис. 3.

Рисунок 2. Терморегуляция под соусом: когда мозг не понимает, жарко ему или холодно! Кто не выкупил: см. подробности на рис. 3 и в тексте статьи.
иллюстрация Елены Беловой
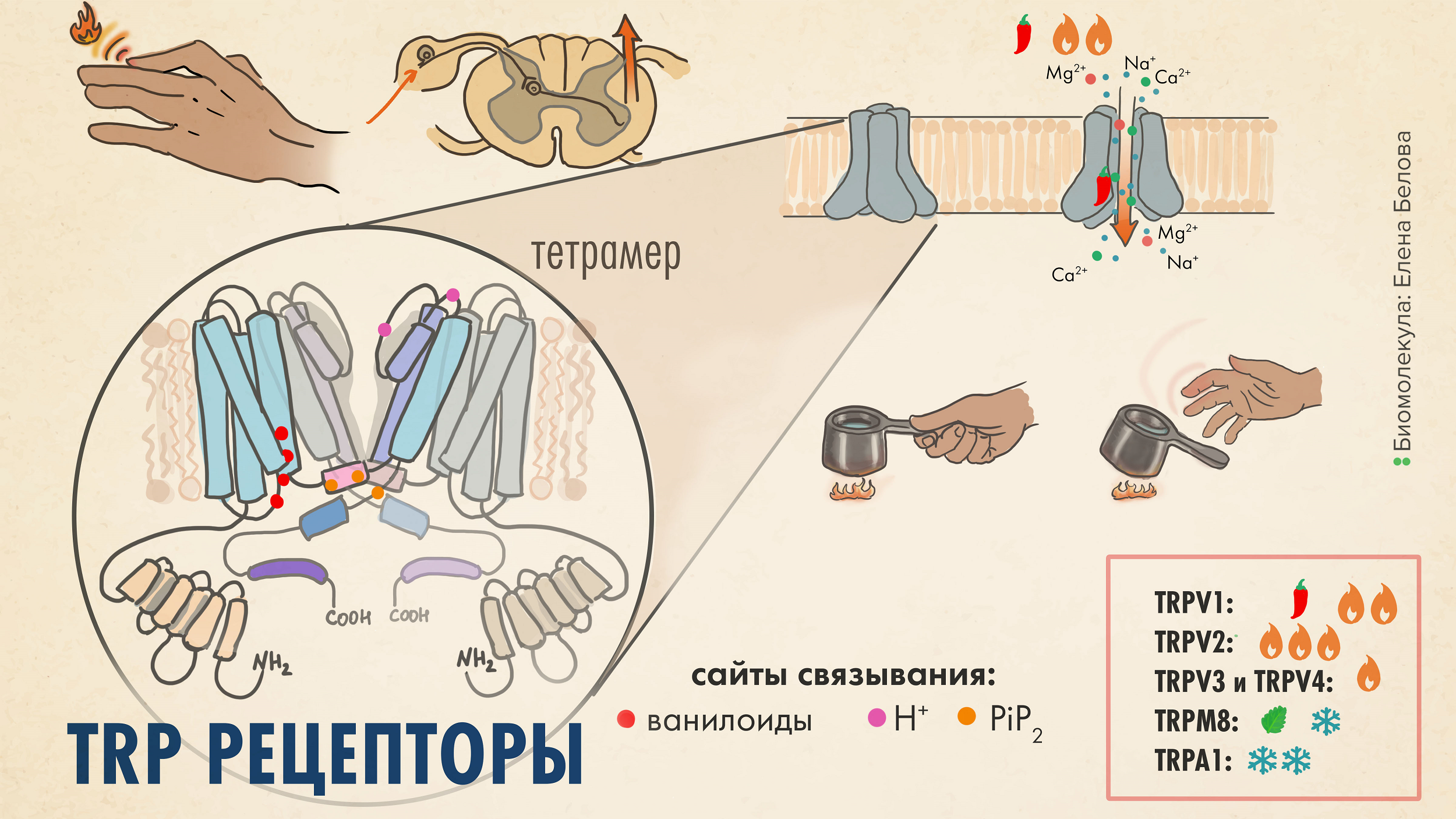
Рисунок 3. TRP-рецепторы — важные молекулярные сенсоры. Когда тетрамерный TRP-рецептор активируется (например, теплом или капсаицином), происходит изменение конформации белка и открывается ионный канал. Это позволяет положительно заряженным ионам, в основном Ca2+ и Na+, входить внутрь ноцицептивного (болевого) нейрона. Приток ионов приводит к деполяризации мембраны и формированию потенциала действия. Нервный импульс, распространяясь по мембране, передается в ЦНС, где интерпретируется как болевой или сенсорный сигнал. А вот и основные подтипы TRP рецепторов, знакомьтесь [7], [8]:
- TRPV1 реагирует на капсаицин (тот самый, который содержится в остром перце чили), на повышение кислотности (низкие pH), температуру выше 43 oC, эндоканнабиноиды, брадикинин, этанол и другие раздражители [9];
- TRPV2 активируется при более высоких и разрушительных температурах (>52 oC);
- TRPV3 и 4 — это осморецепторы, которые также реагируют на тепло (30–39 oC);
- TRPM8 (меланостатиновый) активируется ментолом из мяты и холодом [10] (8–28 oC); в то время как
- TRPA1 (анкириновый) реагирует на холод (ниже 17 oC), горчичное масло и коричный альдегид.
иллюстрация Елены Беловой
Температура, механические стимулы или агонисты этих рецепторов открывают ионный канал (пропускающий все катионы без особой селективности), что приводит к формированию потенциала действия и передаче нервного возбуждения к следующему нейрону [7], [11]. Однако не все так просто — эта чувствительность может модулироваться разнообразными состояниями и активностью ряда других рецепторов.
При воспалении выделяются особые медиаторы (такие как брадикинин и простагландины), напрямую или косвенно активирующие TRPV1 (тот самый, который реагирует на жгучий перец), усиливая болевые ощущения (явление, называемое гипералгезией). Опиоидные анальгетики, о которых речь пойдет ниже, могут опосредованно влиять на TRPV1-рецепторы, снижая их чувствительность. Еще интереснее то, что между опиоидными рецепторами и TRPV1 существует двусторонняя связь [12]: активация TRPV1 может усиливать анальгетический эффект опиоидов, в то время как длительный прием опиоидных анальгетиков, наоборот, может вызвать увеличение количества TRPV1 рецепторов и гиперальгезию (рис. 4). О похожей «синергии» между капсаицином и местными анестетиками (такими как лидокаин) мы уже писали: «Жгучий перец облегчит боль» [9].
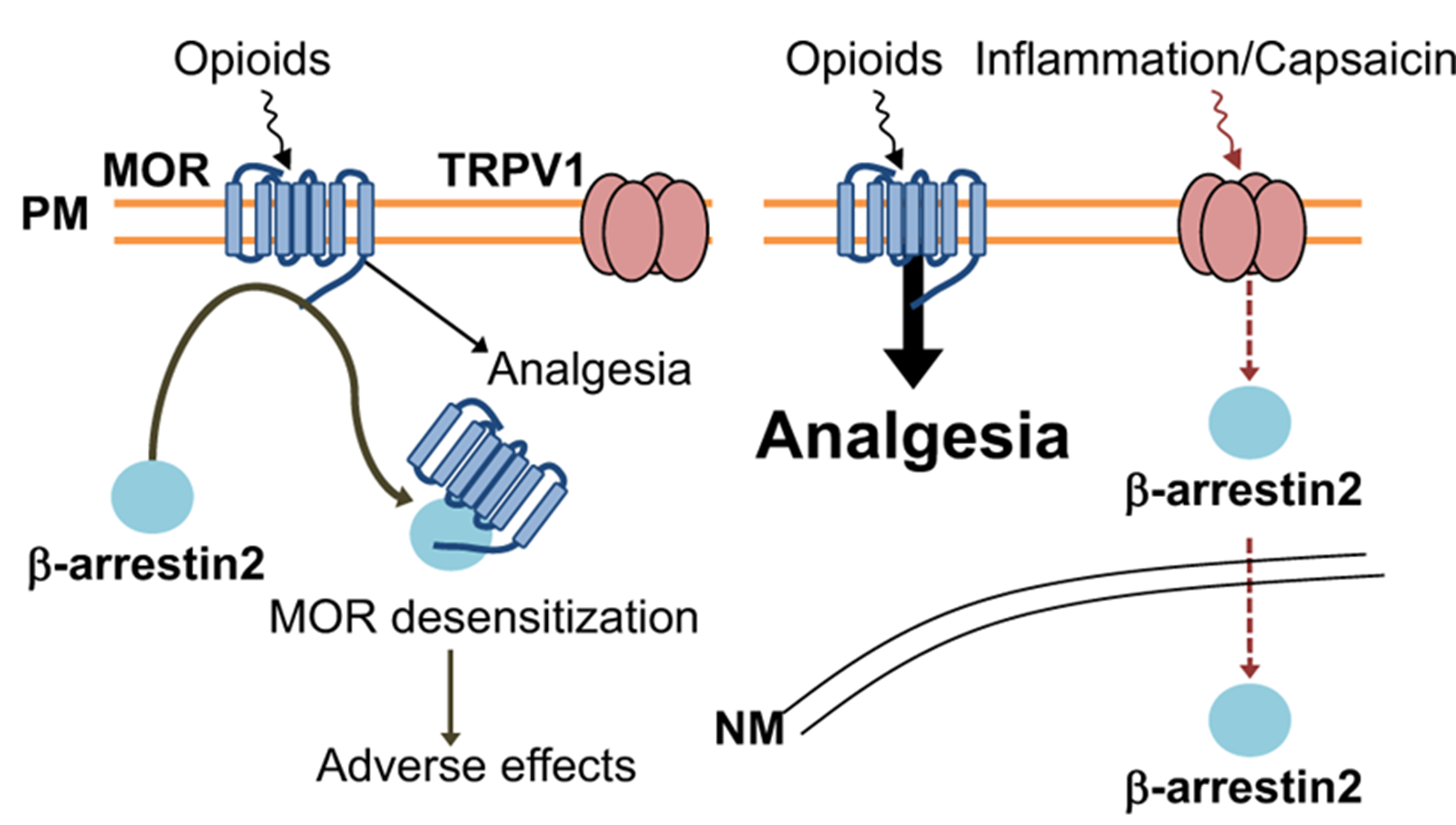
Рисунок 4. Перезагрузка опиоидов: секрет β-аррестина в борьбе с болью и привыканием к опиоидам. Опиоиды связываются μ-опиоидным рецептором (MOR) на поверхности нервных клеток, вызывая обезболивание. Белок β-аррестин-2 отвечает за интернализацию рецепторов внутрь клетки (эндоцитоз), и при длительной активации все меньше μ-рецепторов остается на поверхности клетки, из-за чего необходимо увеличивать дозу обезболивающего. При воспалении активируется рецептор TRPV1, который перенаправляет β-аррестин-2 в клеточное ядро. А μ-опиоидные рецепторы дольше остаются на поверхности клетки и обеспечивают лучшее обезболивание.
Без всякого сомнения, изучение TRP-рецепторов нужно не только для развлечения биохимиков, но и чтобы сделать эти белки новой мишенью для обезболивающих препаратов. Например, местные средства, содержащие капсаицин, могут временно снижать чувствительность TRPV1 в месте нанесения. Однако на данный момент на рынке нет анальгетиков, блокирующих TRP-каналы, хотя попытки их разработать неоднократно предпринимались. Частый побочный эффект у экспериментальных блокаторов — это гипертермия (то есть повышение температуры), а это совсем не то, чего ждут от анальгетика. Поэтому на данный момент TRP-ингибиторы не прошли дальше первой фазы клинических испытаний, однако работа продолжается. Один из многообещающих проектов разрабатывается в Институте биоорганической химии, где изучают пептидные антагонисты TRPV1, снижающие болевые эффекты в экспериментах in vivo без проявления гипертермии [13], [14].
Кислоточувствительные ионные каналы (ASIC) —
семейство катионных каналов, которые открываются при снижении pH, то есть при увеличении кислотности межклеточной среды. ASIC’и обнаружены в нейронах центральной и периферической нервной системы, но в первую очередь — в терминалях C-волокон. Это важнейшие сенсоры боли, особенно той, которая возникает при воспалении, ишемии, повреждении тканей или других состояниях, сопровождающихся локальным снижением pH [8]. Еще ASIC’и вовлечены в механизм нейропатической боли, а также в болевые ощущения, возникающие в мышцах и суставах (рис. 5).
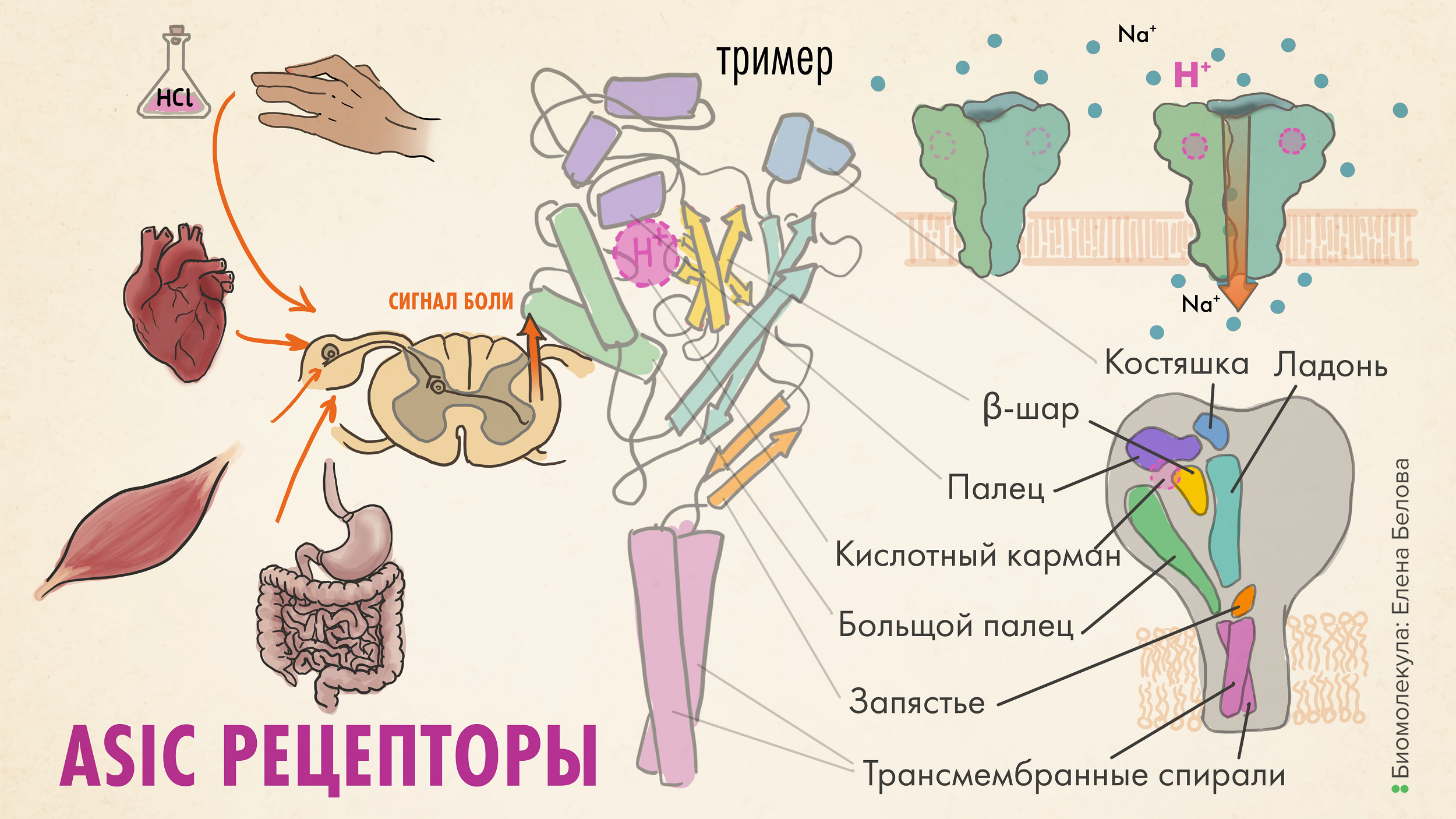
Рисунок 5. Кислоточувствительный ионный канал (ASIC) — сенсор боли. Эти каналы «включаются» под действием кислоты, а точнее, ионов H+. Кислота может накапливаться в тканях в результате воспаления и активировать терминали C-волокон. Открываясь, канал пропускает ионы Na+ (а иногда и Ca2+), и это, как и в случае с TRP-каналами, приводит к формированию нервного импульса, распространяющегося по чувствительным нейронам в ЦНС. Канал ASIC-рецепторов сформирован тремя субъединицами; каждый мономер состоит из двух трансмембранных доменов (TM1 и TM2) и большого внеклеточного домена, описываемого как «кулак»: finger (палец), knuckle (костяшка), thumb (большой палец), palm (ладонь: центральный элемент), β-ball (β-шар) и wrist (запястье). Когда протон попадает в «кислотный» карман, образованный доменами «пальцев», «ладони» и «костяшки», «рука» разжимается, субъединицы сдвигаются и открывают ионный канал.
иллюстрация Елены Беловой
Среди подтипов рецепторов ASIC наиболее важную роль играют изоформы 1 и 3. Увеличение концентрации H+ при закислении активирует ASIC3 на периферических ноцицептивных нейронах типа C, вызывая формирование болевого стимула. Экспрессия ASIC3 усиливается в нейронах задних ганглиев спинного мозга после воспаления и повреждения нервов. Также этот подтип рецепторов участвует в появлении ишемической боли в сердце и разных вариантов хронической боли, поскольку они локализованы с обоих концов псевдоуниполярных чувствительных нейронов [15].
Каналы ASIC1 участвуют в процессах центральной сенситизации — увеличении чувствительности ноцицепторов при хронической боли. Также есть данные, что на ASIC1 могут опосредованно действовать опиоидные анальгетики. В литературе описаны как положительные модуляторы, так и ингибиторы ASIC. К активаторам относятся некоторые ионы металлов и нейропептиды, родственные опиоидным пептидам. Ингибиторы ASIC включают неспецифические и неселективные молекулы [15], [16], а также высокоспецифичные природные пептидные токсины, выделенные из животных ядов (например, из яда морских анемонов). Однако на данный момент изучение ASIC’ов не привело к созданию новых анальгетиков — будем надеяться, все еще впереди.
Пуринергические рецепторы
Чувствительные нейроны, участвующие в передаче болевого сигнала в задние корешки спинного мозга, активируются также с помощью пуринергических рецепторов. Медиатором болевого сигнала в этой области служит хорошо известная молекула АТФ . При повреждении тканей из клеток высвобождается большое количество АТФ, которая связывается с P2X-рецепторами на терминалях C- и Aẟ-волокон. Активация P2X-рецепторов приводит к притоку положительных ионов (главным образом Na+ и Ca2+) в нейрон. Это вызывает деполяризацию мембраны и генерирует нервный импульс, который передается в центральную нервную систему как болевой сигнал.
Поэтому они и называются пуринергическими — ведь АТФ с химической точки зрения относится к пуринам: «Вторая жизнь АТФ: от главной батарейки до нейромедиатора» [17].
Для передачи боли главным образом важна изоформа P2X3, расположенная в пресинаптической мембране чувствительных нейронов (рис. 6). Другие подтипы P2X — P2X2, P2X4, P2X7 — также активно участвуют в появлении разных типов боли: ноцицептивной, нейропатической и вызванной воспалением.
Роль P2Y-рецепторов — а это уже не ионные каналы, а G-белок сопряженные рецепторы [18] — в острой боли менее выражена, чем для P2X; но они важны для модуляции болевых сигналов, особенно при хронической боли. Некоторые их подтипы (например, P2Y12) играют роль в развитии нейропатической боли. Они экспрессируются на глиальных клетках (микроглии), которые при активации выделяют провоспалительные цитокины, усиливающие болевые ощущения. Другие P2Y-рецепторы могут влиять на высвобождение медиаторов воспаления, что способствует возникновению воспалительной боли [8]. В отличие от TRPV и ASIC, в отношении пуриновых рецепторов фармакология достигла бóльших успехов — о них читайте в следующих главах нашей статьи.
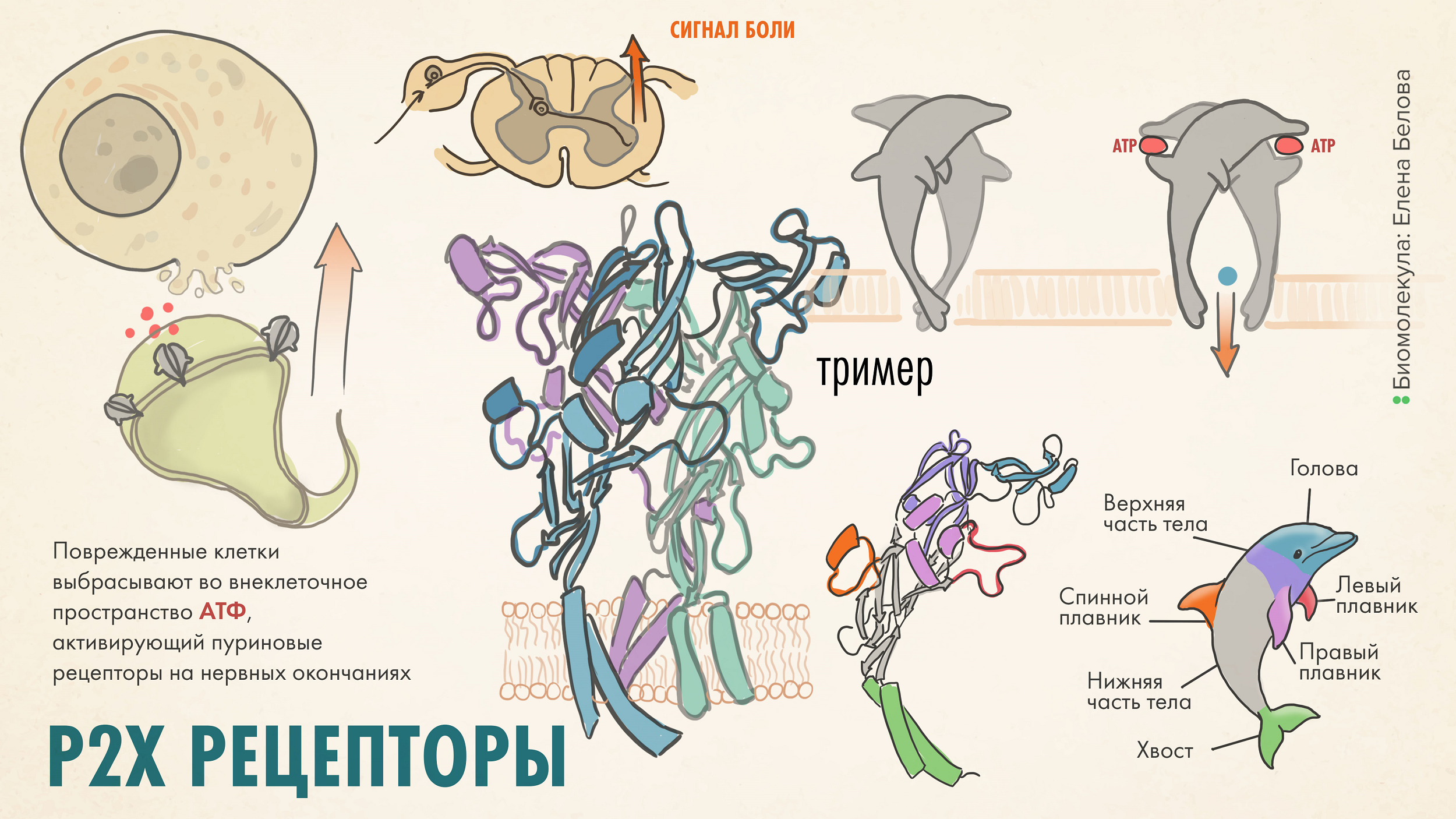
Рисунок 6. Пуриновые рецепторы P2X — перспективная мишень новых анальгетиков. Активируются связыванием АТФ, высвобождаемой из поврежденных клеток или нервных окончаний, что приводит к быстрому открытию канала и проведению нервного импульса. Это способствует высвобождению глутамата чувствительными нейронами и передаче болевого сигнала вставочным нейронам и далее, в головной мозг. Несколько изоформ P2X участвуют в болевой активации, и все они похожи по строению: это тример (гомо или гетеро). Каждый мономер напоминает по форме дельфина и даже имеет обозначения, соответствующие частям тела этого обаятельного морского млекопитающего. Какую надежду P2X дают в сфере анальгезии — читайте далее.
иллюстрация Елены Беловой
Дорога боли: как устроены пути передачи и обработки болевого сигнала
Теперь снизим увеличение и переведем фокус с молекул на анатомические структуры, участвующие в передаче болевого сигнала (рис. 7). Анатомически тела этих нейронов локализованы в задних корешках спинного мозга, в специальных нервных узлах. Нейроны задних корешков псевдоуниполярны. Выходя из тела нейрона, отросток раздваивается: одна его половина идет на периферию (туда, где нервное окончание воспринимает болевой сигнал), а другая тянется в задний рог спинного мозга. Достигая задних рогов, терминали чувствительного нейрона (первого порядка) встречаются с интернейроном (нейрон второго порядка), который будет обеспечивать следующий этап передачи болевого сигнала вверх по спинномозговым трактам (трансмиссия).
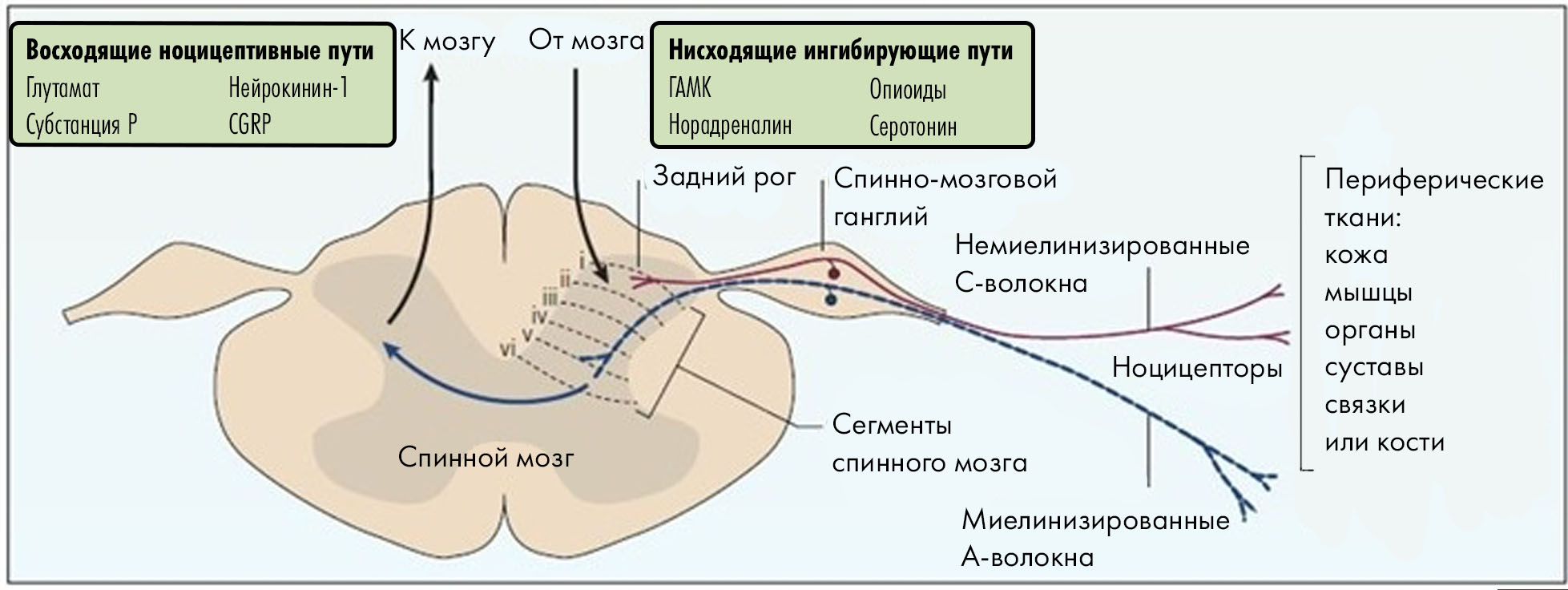
Рисунок 7. Туда и обратно: как устроена система передачи сигнала в спинном мозге. Туда: в восходящей передаче болевого сигнала, чтобы «передать эстафету» от одного нейрона к другому, могут использоваться разные нейромедиаторы: от всем хорошо известного глутамата до нейропептидов (таких как субстанция Р, нейрокинин-1 и CGRP). Кстати, CGRP играет особую, даже ключевую роль в той боли, которая возникает при мигрени (о чем будет сказано особо). Обратно: мозг не просто «принимает» сигнал, он активно управляет им. Он посылает собственные сигналы обратно в спинной мозг, чтобы при необходимости подавить боль. Эти пути используют мощные естественные обезболивающие: опиоиды (эндорфины), а также норадреналин, серотонин и ГАМК. Они тормозят передачу болевого сигнала на уровне заднего рога. Именно этот механизм используется при обезболивании опиоидными анальгетиками.
Модуляция боли
В задних рогах спинного мозга болевой сигнал подвергается модуляции, в том числе с участием других сенсорных сигналов. Согласно «воротной теории» боли, ноцицептивные волокна (C и Aδ) передают болевые сигналы, которые как бы «открывают ворота», а толстые неноцицептивные волокна (Aβ) при активации (прикосновение и давление) передают сигналы, которые «закрывают ворота», заглушая боль (рис. 8). Мозг также может влиять на «ворота», усиливая или ослабляя боль с помощью эмоций, внимания и ожиданий [19].
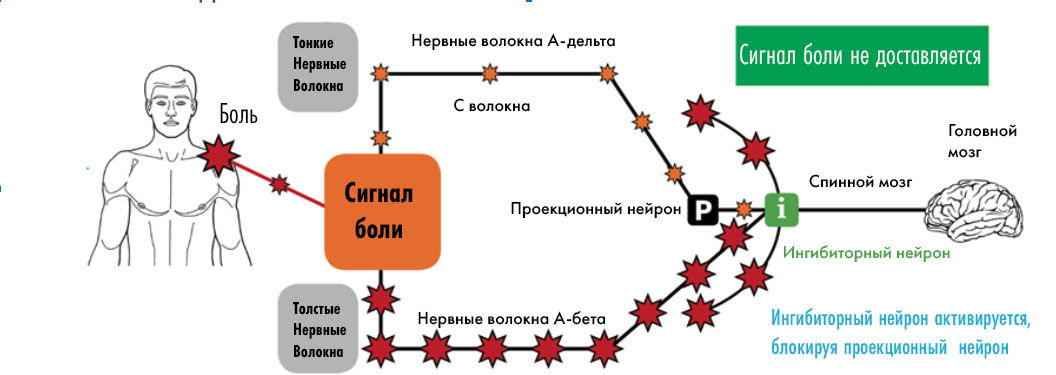
Рисунок 8. Воротная теория боли.
Далее нейроны второго порядка переходят на противоположную сторону спинного мозга и поднимаются в мозг по восходящим путям (рис. 9А).
- Спиноталамический тракт: основной путь, по которому информация о боли и температуре передается в мозг.
- Неоспиноталамический тракт: отвечает за дискриминативную (четко локализованную) боль.
- Палеоспиноталамический тракт: передает информацию о диффузной боли, а также участвует в вегетативных и эмоциональных реакциях на боль.
Восприятие боли
Достигнув головного мозга, терминали нейронов второго порядка попадают в таламус — основной центр обработки болевого сигнала (рис. 9Б) [20]. Нейроны второго порядка передают импульс нейронам третьего порядка в ядрах таламуса. В нем происходит первичная сортировка и интеграция болевых сигналов. Из таламуса сигналы направляются в различные отделы коры, где происходит осознанное восприятие боли.
- Восприятие боли (перцепция) —
- финальный нейрофизиологический процесс, при котором объединение сигналов от предыдущих этапов (трансдукции, трансмиссии и модуляции) преобразуется в субъективное осознанное ощущение боли
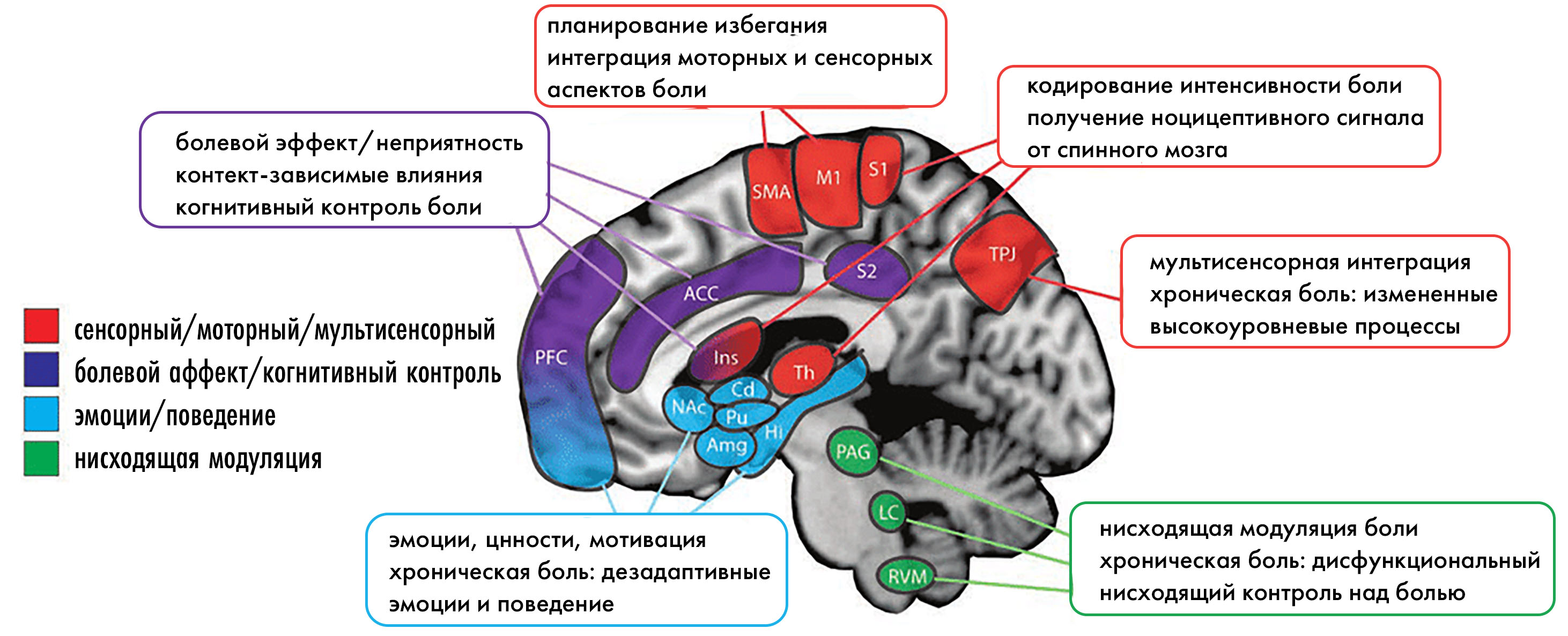
Соматосенсорная кора отвечает за восприятие локализации боли и ее интенсивности. Лимбическая система (миндалина и гиппокамп) — это эмоциональный аспект восприятия боли: страх, тревога и ее запоминание. Островковая кора участвует в субъективном переживании боли и формировании болевого сознания. Передняя поясная кора отвечает за мотивационный и аффективный компоненты боли. Болевые сигналы также обрабатываются в стволе мозга, который участвует в ответных реакциях на боль. Ретикулярная формация активирует системы бодрствования и внимания в ответ на сильную боль. Серое вещество вокруг водопровода (Periaqueductal Gray, PAG): ключевая структура в центральной системе подавления боли. PAG активирует нисходящие пути, которые могут ингибировать передачу болевого сигнала в спинном мозге, выделяя эндогенные опиоиды.
Как познать боль: методы изучения болевых синдромов и поиска препаратов для их лечения
Эффективные обезболивающие препараты — это не только часть комплексной терапии, но и общее повышение качества жизни, обещание, что в случае болезни пациенту будет обеспечено гуманное отношение. Хотя исследования боли и разработки новых обезболивающих препаратов активно ведутся, за последние десятилетия новых анальгетиков с принципиально иным механизмом действия появлялось довольно мало. И это при том, что нам известно очень многое о молекулярных механизмах боли. Существует множество потенциальных мишеней для новых лекарственных препаратов. При этом наблюдается рост рынка, связанный с усовершенствованием существующих препаратов и появлением безрецептурных средств. Согласно исследованию, опубликованному в журнале Nature Reviews Drug Discovery [21], доля новых обезболивающих, входящих в клинические испытания, снизилась с 2,5% (2000–2002 гг.) до 1,7% (2013–2015 гг.). За это же время увеличилось число реформулированных продуктов — лекарств, содержащих то же самое действующее вещество, но с другими вспомогательными компонентами, формой или способом доставки.
В чем же дело? Разработка новых препаратов сопряжена с большими финансовыми затратами и высоким риском неудачи, особенно на поздних стадиях клинических испытаний. Как вы уже заметили по объемной первой половине статьи, боль — это сложное и многомерное явление, включающее различные патофизиологические механизмы. Также существующие доклинические модели на животных не всегда точно предсказывают эффективность у людей [21]. Кроме того, разработка самых сильных анальгетиков — опиоидных препаратов — всякий раз упирается в риск развития тяжелой зависимости у пациентов: проблему, которую пока так и не удалось решить.
Доклинические модели
Вместе с тем, испытание препаратов на животных — неотъемлемый этап разработки нового лекарства, который проводится, чтобы убедиться в его безопасности и эффективности, прежде чем новый анальгетик можно будет тестировать на людях: «От живого к неживому. Доклинические исследования сегодня и завтра» [22]. Какова специфика доклиники (доКИ) при разработке обезболивающих препаратов?
В таких исследованиях в основном используются грызуны, поскольку их нервная система в достаточной мере схожа с человеческой. Особенность доКИ анальгетиков на животных в том, что боль — это субъективное переживание, которое невозможно напрямую измерить, а крыса или мышь не скажет экспериментатору, на сколько баллов из 10 ей больно. Исследователи вынуждены полагаться на поведенческие реакции и физиологические показатели, которые лишь косвенно указывают на наличие боли и ее интенсивность. Поэтому важно разработать такой протокол эксперимента, который позволит в явном виде выявить реакцию животного на болевой стимул или его снижение на фоне введения обезболивающего препарата.
Для этих целей используют селективные и неселективные модели болевого воздействия (см. врезку). Неселективные модели имитируют определенное воздействие (температурное, кислотное или влияние воспалительных процессов), чтобы оценить общий анальгетический потенциал средства, но без влияния на конкретную молекулярную мишень. Селективные же предполагают имитацию конкретного заболевания (например, накладывание лигатуры на тройничный нерв, модель невралгии) и, как правило, имеют конкретный молекулярный механизм, который помогает оценить селективность действия нового препарата.
Клинические исследования новых анальгетиков
В отличие от доКИ на животных, где используются поведенческие модели, у человека для изучения боли и тестирования препаратов применяются более разнообразные методы, учитывающие как физиологические, так и субъективные аспекты. Для того, чтобы количественно или качественно оценить интенсивность боли, используют стандартизованные шкалы (рис. 2) и протоколы тестирования. Более специфичные шкалы, такие как DN4, LANSS и NDI, используются для оценки различных аспектов боли, но каждая из них имеет свою специфику и назначение (см. врезку).
Клинические испытания новых анальгетиков
Если доклинические исследования нового препарата прошли успешно, то следующий этап разработки — это клинические испытания. У «Биомолекулы» есть целый спецпроект на эту тему (см., например, «С миру по нитке: как соединились компоненты клинического исследования» [24]), поэтому мы лишь вкратце остановимся на самых основных моментах.
Клинические испытания анальгетиков имеют ряд уникальных особенностей, которые отличают их от исследований других лекарств. Используемые при испытаниях шкалы и болевые модели, описанные выше, слишком субъективны, и поэтому их сложно интерпретировать (в отличие, например, от трактовки данных уровня глюкозы в крови или общего холестерина при исследовании антидиабетических препаратов).
Таким образом, несмотря на то что в данный момент механизмы боли достаточно хорошо изучены, поиски новых препаратов сопряжены с трудностями объективной оценки обезболивающего эффекта. Один из основных, если не самый главный тренд в разработке анальгетиков — это поиск не только эффективного, но и безопасного средства, которое не вызывает наркотической зависимости. Ведь существующий на данный момент опиоидный кризис постепенно выходит за рамки отдельных государств и становится общемировой проблемой. Давайте теперь посмотрим, какими обезболивающими средствами мы обладаем сегодня и каковы шансы улучшить ситуацию с анальгетиками завтра.
Как прогнать боль: анальгетики на современном фармрынке
Теперь, когда мы познакомились с основными механизмами возникновения и передачи болевого сигнала, а также способами изучения боли, настало время разобраться с тем, какими обезболивающими возможностями обладает современная фармакология. История поиска и разработки анальгетиков по-настоящему захватывающая и драматичная, ведь за каждым лекарственным препаратом стоят годы работы и миллионы пациентов, нуждающихся в помощи. Сейчас в клинике используют множество анальгетиков, которые традиционно делят на опиоидные и неопиоидные (читайте: наркотические и ненаркотические). В последние десятилетия перечень ненаркотических обезболивающих препаратов сильно расширился. Если раньше в него входили в основном нестероидные противовоспалительные препараты, то есть ингибиторы циклооксигеназы, то сейчас к ним можно отнести препараты, действующие на самые разные мишени.
Также важно знать: в борьбе с болью используются не только классические анальгетики, но и препараты смежных классов, способные влиять на передачу и восприятие болевых сигналов. Заметную роль в лечении хронических и нейропатических состояний играют антидепрессанты — их часто называют адъювантными анальгетиками. Они помогают усиливать действие обезболивающих или самостоятельно подавляют хроническую боль.
Опиоидные анальгетики — спасение или проклятие?
Первая минута: ощущение прикосновения к шее. Это прикосновение становится теплым и расширяется. Во вторую минуту внезапно проходит холодная волна под ложечкой, а вслед за этим начинается необыкновенное прояснение мыслей и взрыв работоспособности. Абсолютно все неприятные ощущения прекращаются. Это высшая точка проявления духовной силы человека. И если б я не был испорчен медицинским образованием, я бы сказал, что нормально человек может работать только после укола морфием. В самом деле: куда, к черту, годится человек, если малейшая невралгийка может выбить его совершенно из седла!
— Михаил Булгаков, рассказ «Морфий».
Сегодня даже люди, не испорченные медицинским образованием, прекрасно знают об опасности приема опиоидных препаратов (рис. 11). Однако в настоящее время сложно представить более эффективное обезболивающее средство. В этом разделе мы постараемся разобраться в механизме действия опиоидных анальгетиков и узнаем, возможно ли сделать их побочные эффекты менее опасными для человека.
Под опиоидными анальгетиками обычно понимают все естественные и полусинтетические производные алкалоидов опия, а также синтетические препараты, имитирующие действие морфина. Некоторые опиоиды обладают пролонгированным действием (оксикодон), а другие заметно сильнее хорошо известных морфина и героина, из-за чего обладают более высоким потенциалом для злоупотребления. Помимо традиционных опиоидов, в клинике применяют анальгетики, обладающие антагонистическим действием по отношению к морфину (антагонисты — например, налоксон; а также смешанные агонгисты-антагонисты, такие как бупренорфин). Более того, существование эндогенных пептидов с анальгетическими свойствами (такие как Р-эндорфин и энкефалины) предполагает, что разработка их синтетических аналогов может быть эффективной стратегией создания новых опиоидных анальгетиков [28].
Опиоиды, помимо собственно обезболивания, вызывают эйфорию, седативный эффект, угнетение дыхания, замедление пищеварения и сужение зрачков. При длительном употреблении вызывают физическую и психологическую зависимость. Они работают на уровне центральной нервной системы, и чаще всего их назначают при острой боли: после хирургического вмешательства, при травмах (вывихи, обширные ожоги, переломы и другие ранения), при почечных и желчных коликах и остром панкреатите. А также при хронической боли, вызванной онкологическими заболеваниями, остеоартритом, ревматоидном артритом и другими подобными недугами.
Механизм действия опиоидов
Давайте теперь разберемся, как именно работают опиоидные анальгетики на молекулярном уровне. У любого лекарственного препарата есть своя мишень, для опиоидов — это рецепторы, известные как μ-, δ-, κ- и рецептор ноцицептина (ν). Разнообразные эффекты опиоидов реализуются в зависимости от подтипов опиоидных рецепторов, а также типа передачи сигнала и локализации (рис. 12) [29].
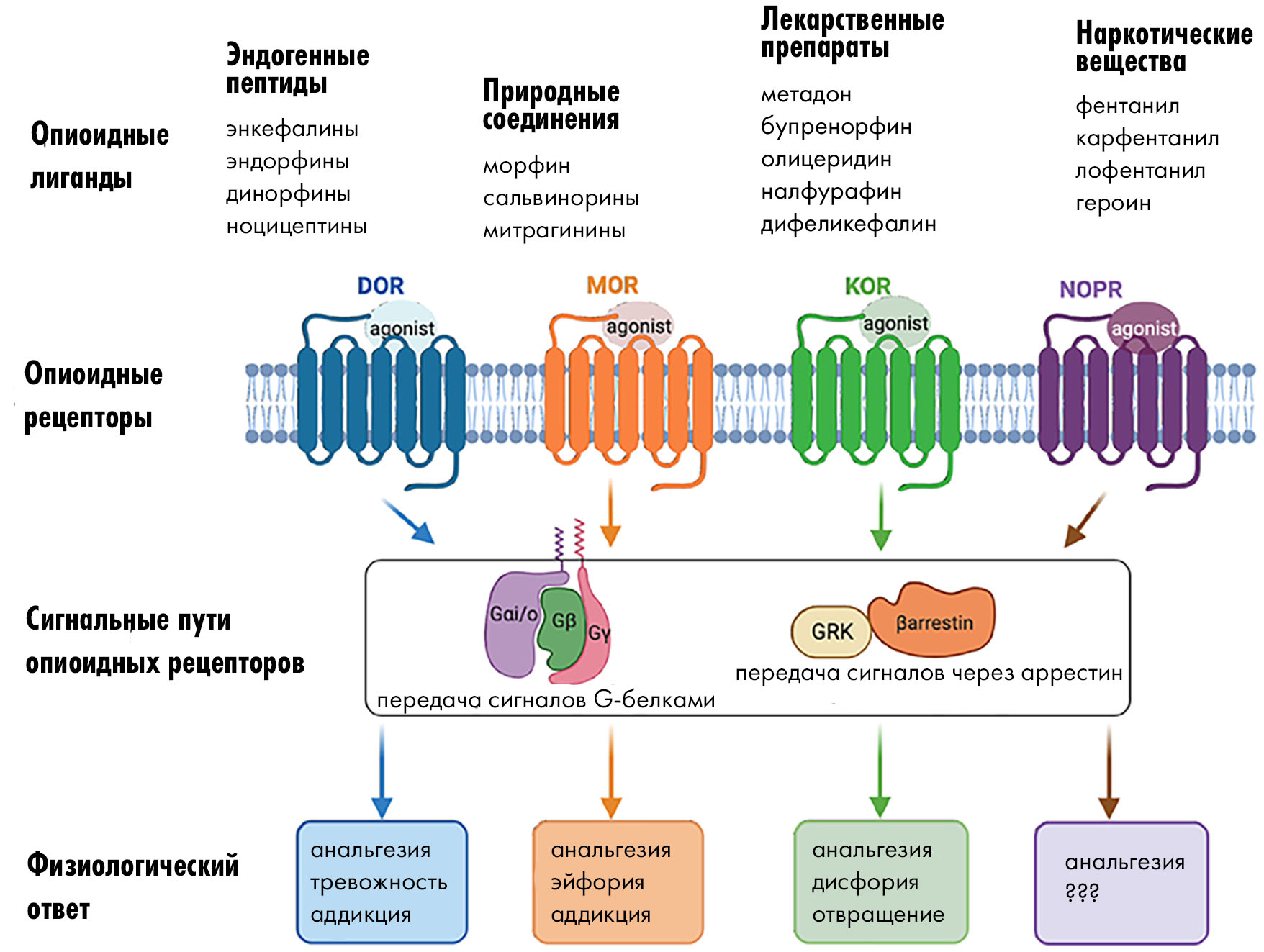
Рисунок 12. От обезболивания до зависимости: как разные подтипы опиоидных рецепторов (δ- (DOR), μ- (MOR), κ- (KOR) и ν- (NOR)) влияют на физиологию нервной системы. Эти рецепторы относятся к семейству GPCR, а потому их сигналы передаются G-белками или аррестином.
Отдельного внимания заслуживают эндогенные лиганды опиоидных рецепторов [30] — пептиды, вырабатываемые в организме человека и выполняющие функции нейромедиаторов и нейрогормонов. Среди них можно отметить эндорфины, энкефалины, динорфины и эндоморфины. Спектр их эффектов очень широк: от обезболивания и эмоциональной реакции на стресс до регуляции работы дыхательной и пищеварительной систем. В целом, опиоидная система является неотъемлемой и очень важной частью механизма поддержания гомеостаза в организме и адаптации к изменяющимся условиям внешней среды. Эндогенная опиоидная система играет важную роль в системе вознаграждения мозга, регулируя удовольствие и мотивацию. Когда экзогенные наркотические вещества активируют эту систему, имитируя или усиливая действие естественных опиоидов, это приводит к адаптивным изменениям в мозге и способствует формированию зависимостей.
Механизм действия опиоидных рецепторов уже совсем не похож на тот, что мы видели у рецепторов TRP, ASIC и P2X. Все опиоидные рецепторы относятся к классу G-белоксопряженных рецепторов (GPCR) [31–33]. Эти белки лишены ионных каналов, поэтому при связывании с агонистом-опиоидом рецепторы взаимодействуют с адапторными G-белками, которые находятся на внутренней стороне мембраны клетки. В зависимости от того, с каким именно белком связался рецептор, «включается» тот или иной путь передачи сигнала внутри клетки. Опиоидные GPCR чаще всего связываются с гетеротримерными Gi/o-белками, GPCR-киназами (GRK) или β-аррестинами. Первые при активации распадаются на α- и βγ-субъединицы. Далее Gαi/о-субъединица взаимодействует с ферментом аденилатциклазой, которая превращает молекулы АТФ в циклический АМФ (цАМФ) — крайне важную сигнальную молекулу в клетке. В клетке существует несколько подтипов Gα-субъединиц, но Gαi/о вызывает снижение уровня цАМФ, что блокирует передачу некоторых сигналов внутри клетки. В результате действия опиоидов через Gi/о-белки происходит гиперполяризация мембраны и снижение возбудимости нейронов, и наконец — снижение передачи болевых импульсов и развитие анальгетического эффекта [34].
Другие адапторные белки, β-аррестины, регулируют чувствительность нервных клеток к опиоидам. Они отвечают за интернализацию связанного с лигандом рецептора — его перемещению с поверхности мембраны внутрь клетки в составе везикулы. В результате наступает десенситизация. Будет ли лиганд активировать тот или иной путь — важный вопрос (см. врезку далее).
- Десенситизация —
- снижение количества рецепторов на мембране, которое приводит к снижению чувствительности клетки к действию препарата. Это один из основных механизмов поддержания гомеостаза клетки, призванный не допустить чрезмерное влияние лиганда на жизнедеятельность клетки. Этот же механизм лежит в основе развития привыкания к опиоидам: снижение чувствительности клетки к действию препарата ведет к повышению дозировки и формированию зависимости.
Какие опиоиды используются в клинике
В клинике используют ряд опиоидных препаратов, которые отличаются как по выраженности обезболивающего эффекта, так и по продолжительности действия. Многие из этих препаратов мы знаем из фильмов и сериалов (чего стоит викодин доктора Грегори Хауса из одноименного сериала; рис. 11А). При острых болях часто используют морфин, фентанил, оксикодон, а для менее выраженного болевого синдрома — трамадол. Список наиболее часто используемых опиоидов можно найти в таблице 1 ниже.
Бесконтрольное использование опиоидов приводит развитию зависимости, что стало глобальной медицинской и социальной проблемой. По данным ВОЗ, на 2022 год количество людей с зависимостью от опиоидных препаратов достигло 60 млн. Поэтому заместительная терапия (ЗТО) — еще один важный способ применения опиоидов. Суть ЗТО состоит в плавном переводе людей с наркотической зависимостью на специальные препараты — тоже опиоиды, но с некоторыми особенностями. Обычные опиоидные препараты, например, морфин или фентанил, связываются с µ-опиоидными рецепторами и вызывают быстрый и очень сильный эффект, который приводит к скорому снижению чувствительности нервных клеток, а затем к увеличению дозы и привыканию.
| Опиоид | Морфиновый эквивалент | Длительность действия (ч) |
|---|---|---|
| Кодеин | 1/10 | 3–6 |
| Дигидрокодеин | 1/8 | 3–6 |
| Петидин | 1/3 | 2–4 |
| Тапентадол | 1/3 | 4–6 |
| Гидрокодон | 2/3 | 4–8 |
| Оксикодон | 1,5 (2) | 3–4 |
| Метадон | 5–10 | 8–12 |
| Гидроморфон | 4–5 (5–7,5) | 4–5 |
| Бупренорфин (сублингвально) | 80 | 6–8 |
| Бупренорфин (трансдермально) | 100 (75–115) | Зависит от формы (72–168) |
| Фентанил (трансдермально) | 100 (150) | 72 |
Как обстоят дела с разработкой новых опиоидов?
Ранее «Биомолекула» уже публиковала статью о перспективах появления новых опиоидных обезболивающих: «Идеальный опиоид, или Как избавиться от Дамоклова меча» [36], но пришло время сделать апдейт. Разбираясь в хитросплетении внутриклеточных сигнальных путей, ученые поняли, что именно на уровне рецептора мы можем «поймать» побочные эффекты опиоидов, то есть снижение чувствительности к действию препарата, которое ведет к увеличению дозы и формированию привыкания. В первую очередь при поиске biased-агонистов выбор пал на μ-опиоидные рецепторы (рис. 13 во врезке выше). Основные терапевтические эффекты опиоидов связаны именно c μ-рецепторами, поэтому внимание исследователей было в большей степени сосредоточено на них. Доказательством стали данные, полученные на мышах с нокаутом β-аррестина-2, при котором у животных усиливался обезболивающий эффект морфина без потери чувствительности µ-опиоидных рецепторов. Также было показано снижение побочных эффектов со стороны ЖКТ и снижение угнетения дыхания.
Развитие теории biased-агонистов опиоидных рецепторов привело к разработке ряда новых препаратов. Первым и пока что единственным из них дошедшим до рынка стал biased-агонист μ-рецепторов олицеридин (TRV130), разработанный компанией Trevena в 2013 году и одобренный в США в 2020 [37], [38]. Однако, несмотря на выраженное обезболивающее действие, он показал лишь умеренные положительные эффекты по сравнению с другими опиоидами с точки зрения соотношения терапевтических и нежелательных эффектов. Его селективность в отношении G-белков при активации μ-опиоидных рецепторов лишь частичная, что и стало одной из причин прекращения продаж препарата. Исследователи предполагают, что разработка лигандов μ-опиоидных рецепторов с более смещенным профилем «агонизма» теоретически могла бы дополнительно усилить положительные эффекты подобного класса лигандов.Так что эффект от подобного подхода был признан скорее положительным, поэтому поиск агонистов в этом направлении продолжается.
В настоящее время в процессе исследования находятся такие препараты, как PZM21, который показал G-белок-смещенный профиль и способность вызывать обезболивание с меньшим количеством побочных эффектов по сравнению с морфином. Но, несмотря на долгие годы исследований, до клинических испытаний пока дело так и не дошло, поскольку в относительно высоких дозах препарат все-таки вызывает угнетение дыхания и привыкание. Аналогичная участь постигла препараты на основе пиперидина, названные SR-соединениями (например, SR-17018).
Таким образом, уже сейчас понятно, что за побочные эффекты опиоидов отвечают далеко не только β-аррестины. Существует теория, согласно которой снижение чувствительности и привыкание к опиоидам может быть связано с активацией не только μ-опиоидных рецепторов, но и других подтипов: κ, δ и ν. В связи с этим развитие получили исследования бифункциональных агонистов или агонистов-антагонистов опиоидных рецепторов. Несколько агонистов-антагонистов уже одобрено и используется в том числе для ЗТО, как описано выше (бупренорфин, налбуфин и пентазоцин). Все эти препараты активируют μ-изоформу и ингибируют δ-рецептор, что, как полагают разработчики, снижает побочные эффекты. Также перспективной стратегией считается разработка двойных μ/ν-агонистов. Так, например, препарат цебранопадол (Tris Pharma) вызывает активацию ν-рецепторов, что противодействует угнетению дыхания, вызываемому опиоидами. В клинических исследованиях, которые препарат проходит в настоящее время, цебранопадол демонстрировал меньший риск угнетения дыхания по сравнению с оксикодоном. Также перспективными направлениями является поиск бифункциональных μ/κ- и κ/δ-агонистов, а также μ-агонистов/δ-антагонистов [34].
Развитие побочных эффектов также связывают с действием опиоидов на другие рецепторы и внутриклеточные сигнальные пути. Возможными кандидатами тут могут быть толл-подобные рецепторы врожденной иммунной системы (TLR4), которые неселективно активируются опиоидами. Также морфин и его аналоги могут опосредованно влиять на NMDA-рецепторы, активируемые глутаматом. Развитие более селективных препаратов, не затрагивающих эти рецепторы, также может привести к созданию более безопасных препаратов.
Таким образом, на сегодняшний день перспектива создания безопасных опиоидных препаратов, не вызывающих зависимости, выглядит реальной, но все еще не достигнутой задачей. Ее решение лежит не только в области наших технических возможностей, но и в человеческом факторе. Опиоидный кризис, бушующий в настоящее время в США, стал возможен в том числе из-за целенаправленного продвижения опиоидных препаратов (например, оксиконтина компании Purdue Pharma) на фармацевтический рынок страны в 90-е. В это время опиоидные препараты активно рекламировали, а риски злоупотребления преуменьшали. Продажи оксиконтина принесли компании миллиарды долларов, сделав их владельцев одними из богатейших людей Америки. А общество получило десятки миллионов людей с наркозависимостью и более миллиона подтвержденных смертей с 1999 года — пугающие последствия этого показаны, например, в молодежном сериале «Эйфория» (рис. 11Б). Сможет ли разработка более безопасных опиоидов переломить этот тренд — увидим.
А теперь давайте посмотрим, как обстоят дела на ниве неопиоидных анальгетиков.
Неопиоидные анальгетики: лучше синица в руках?
К неопиоидным обезболивающим относятся препараты, которые облегчают боль, не связываясь с опиоидными рецепторами в центральной нервной системе и, соответственно, не «играя с огнем». Традиционно к этой группе относят нестероидные противовоспалительные препараты (НПВП, НПВС), которые подавляют работу фермента циклооксигеназы (ибупрофен, аспирин и множество прочих) и производные пара-ацетаминофена (парацетамол).
НПВП — рабочие лошадки в мире обезболивающих
Большинство вещей в этом мире не работает, а аспирин работает.
— Курт Воннегут
Нестероидные противовоспалительные препараты (НПВП) — одни из самых назначаемых препаратов в мире. Это та самая таблетка, которая «половина от головы — половина от живота», потому что используется и как обезболивающее, и как жаропонижающее, в общем и целом, как противовоспалительное средство. Также НПВП еще и одни из самых старых лекарств в нашей аптечке, ведь «дедушка» всех противовоспалительных средств — аспирин — был представлен компанией Bayer еще в 1899 году и стал первым успешным массово выпускаемым синтетическим препаратом. Другой препарат, чье название стало нарицательным для обезболивающих средств — это анальгин (метамизол), синтезированный в 1920 году. Анальгин также известен благодаря своей способности снижать мышечные спазмы, а механизм его действия до сих пор вызывает споры среди ученых. Известно, что терапевтический эффект препарата достигается за счет подавления синтеза провоспалительных молекул в тканях, одновременного воздействия на центры боли в таламусе и расслабления гладкой мускулатуры. Несмотря на более чем вековую историю применения аспирина и анальгина, они до сих используются в клинике наравне с последними достижениями фармакологии.
В отличие от опиоидов, НПВП обладают не центральным, а по большей части периферическим действием. Основные эффекты таких анальгетиков связаны с их способностью подавлять синтез простагландинов — веществ, обладающих высокой биологической активностью. Простагландины образуются из арахидоновой кислоты под влиянием фермента циклооксигеназы (ЦОГ). Препараты НПВП снижают боль, уменьшают воспаление и некоторые из них обладают жаропонижающим действием. Эти препараты назначают при легкой и умеренной боли разного происхождения. Также в последние годы выходит много работ, в которых описывается положительный эффект НПВП (например, ибупрофена) при некоторых видах онкологических и нейродегенеративных заболеваний [40].
Так что же не так с ЦОГ-2?
В 1971 году британский фармаколог Джон Вейн сообщил, что ферменты ЦОГ являются основной мишенью ацетилсалициловой кислоты (аспирина), за что был удостоен Нобелевской премии по медицине в 1982 году. Пионерская работа Джона Вейна не только выявила ферменты ЦОГ как молекулярную мишень для НПВП, но и обнаружила, что подавление работы фермента ЦОГ приводит к снижению продукции простагландинов. Позже было обнаружено, что существует как минимум две изоформы ЦОГ. Изофермент ЦОГ-1 важен для нормальной работы пищеварительной системы и в ряде других процессов, а ЦОГ-2 — это основная изоформа, ответственная за появление боли, жара и воспаления [41].
Субстратом для ферментов ЦОГ является арахидоновая кислота — полиненасыщенная 20-углеродная жирная кислота, которая входит в состав фосфолипидов клеточных мембран и служит предшественником большой группы биологически активных веществ, известных как эйкозаноиды. Если арахидоновая кислота окажется субстратом фермента липоксигеназы (ЛОГ), то мы получим вещества из группы лейкотриенов. Если же она окажется в активном центре ЦОГ — образуется простагландин G2, из которого затем образуются вещества, известные как простагландины и тромбоксаны [42].
Основной терапевтический эффект НПВП связан с ингибированием ЦОГ-2, что приводит к снижению продукции простагландинов. Кроме того, НПВП могут снижать уровень сосудорасширяющих простагландинов (PGE2 и PGI2), что приводит к снижению отеков. Также эти вещества вовлечены в обеспечение ноцицептивных реакций, поэтому снижение их синтеза объясняет анальгетический эффект. Простагландин PGE2 подавляет терморегулирующиую активность гипоталамуса, поэтому НПВП способны проявлять жаропонижающие действие. Нежелательные эффекты НПВП связаны с влиянием на ЦОГ-1 (рис. 14). Это прежде всего желудочно-кишечные осложнения, влияние на сердечно-сосудистую систему, нефротоксичность, обострение гипертонии и задержку жидкости. Именно влияние на ЦОГ-1 заставляет ученых продолжать поиск более безопасных препаратов НПВП.
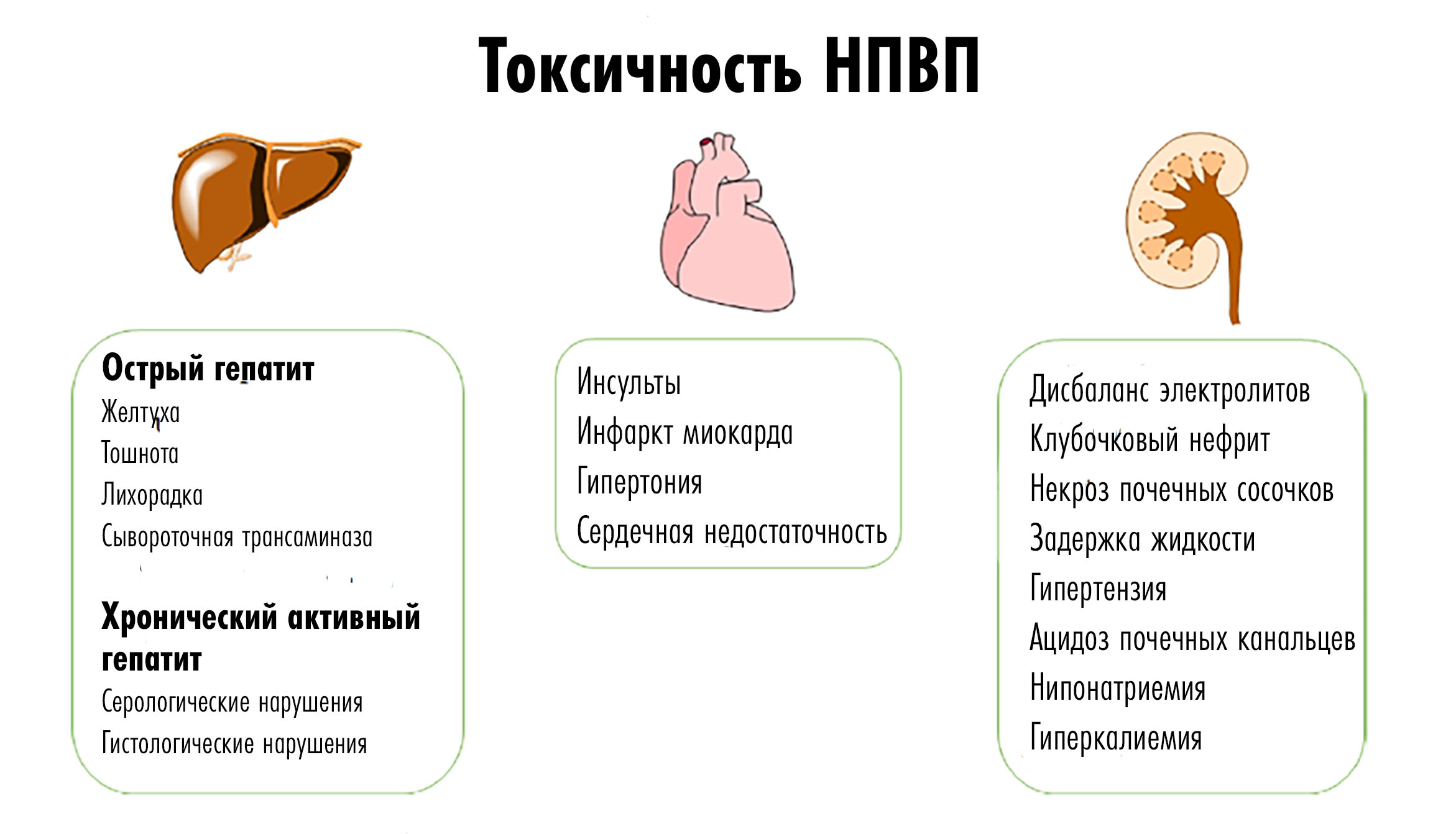
Рисунок 14. Даже привычные НПВП могут влиять на разные органы: вызывать нарушения в работе печени, сердца и почек.
Какие бывают препараты НПВП
Современные НПВП принято классифицировать по химическому строению или по селективности в отношении ЦОГ. Ниже мы приводим таблицу 2, в которой совмещено оба подхода. Химическое строение НПВП разнообразно: среди них есть производные бензойной кислоты, фенолов, пиразолов, уксусной кислоты и многих других веществ. Все ингибиторы ЦОГ так или иначе действуют на обе изоформы. Вопрос в степени их влияния. Если сравнивать количественно, то есть анализировать степень ингибирования (IC50), то все НПВП можно поделить на четыре группы:
- селективные ингибиторы ЦОГ-1;
- преимущественные ингибиторы ЦОГ-1;
- преимущественные ингибиторы ЦОГ-2 и
- неселективные ингибиторы ЦОГ.
Большинство ингибиторов ЦОГ связываются с ферментом временно, а такие препараты, как аспирин, взаимодействуют с ним ковалентно, то есть необратимо. Также НПВП можно разделить по длительности эффекта. НПВП с периодом полувыведения менее 6 часов относятся к категории короткодействующих, а более 10 часов — к категории длительного действия. К короткодействующим НПВП относятся аспирин, диклофенак и ибупрофен. Кстати, о последнем препарате на «Биомолекуле» есть целая статья: «Ибупрофен: расширение горизонтов применения — от стандарта к инновациям» [40]. А такие препараты, как напроксен и целекоксиб, обладают более длительным эффектом.
Еще один распространенный препарат, действующий на ЦОГ, но не относящийся к типичным НПВП, — это ацетаминофен, он же парацетамол. В отличие от НПВП, он в большей степени обладает жаропонижающим, а не противовоспалительным действием. Точный механизм действия ацетаминофена до сих пор неизвестен. Обезболивающие и жаропонижающие эффекты препарата обусловлены в большей степени влиянием на центр терморегуляции в гипоталамусе.
| Химический класс | Селективные ЦОГ-1 | Преимущественно ЦОГ-1 | Неселективные | Преимущественно ЦОГ-2 | Селективные ЦОГ-2 |
|---|---|---|---|---|---|
| Производные бензойной кислоты | Аспирин, Дифлунисал | Флуфенамовая кислота, Толфенамовая кислота, Салсалат, Сульфасалазин, Салицилат натрия, Салициламид, Метилсалицилат, Олсалазин, Месаламин, Салицилат магния |
Мефенамовая кислота, Меклофенамат | ||
| Производные фенола | Парацетамол (Ацетаминофен), Фенацетин | Нимесулид | |||
| Производные пиразола | Фенилбутазон, Сульфинпиразон, Оксифенбутазон, Мофебутазон, Рамифеназон, Пропифеназон, Феназон (Антипирин) | Целекоксиб, Деракоксиб | |||
| Производные уксусной кислоты | Индометацин | Проглуметацин, Оксаметацин, Сулиндак, Зомепирак | Диклофенак, Карпрофен, Этодолак, Ацеклофенак, Толметин | Лумиракоксиб | |
| Производные пропионовой кислоты | Напроксен, Кетопрофен Флурбипрофен | Ибупрофен, Кеторолак, Супрофен, Меклофенамовая кислота, Локсопрофен, Фенопрофен, Ведапрофен, Оксапрозин, Тиапрофеновая кислота | |||
| 4-Гидроксибензотиазин, (Оксикамы) | Пироксикам | Теноксикам, Судоксикам | Мелоксикам, Набуметон | ||
| Хиназолинон | Проквазон | ||||
| Арилгетероциклические соединения | Мефозолак | Рофекоксиб, Фирококсиб, Валдекоксиб, Парекоксиб, Эторикоксиб |
Сузетригин — в полку неопиоидных прибыло
Потенциалчувствительные натриевые каналы (Nav) играют ключевую роль в передаче нервного импульса, поскольку именно с них начинается генерация потенциала действия — быстрого электрического сигнала, распространяющегося по нервным волокнам. Их значение в передаче болевого сигнала также огромно, недаром они служат мишенями местных анестетиков, таких как лидокаин и новокаин, которые неселективно их блокируют. Стоит вспомнить также тетродотоксин — это уже не анальгетик, а яд рыбы фугу, сашими из которой знаменито в Японии, но фармакология у них похожая [44].
Существует девять основных типов этих каналов (Nav1.1–1.9), каждый из которых имеет свою локализацию и функции. Особый интерес для нашей темы представляют Nav1.7 и, в меньшей степени, Nav1.8, которые напрямую связаны с восприятием боли. Мутации в гене, кодирующем канал Nav1.7, могут приводить к редким наследственным заболеваниям, вызывающим врожденную нечувствительность к боли. Открытие роли Nav в передаче боли положило начало исследованиям анальгетического применения блокаторов Nav не только для местного, но и общего действия. Их результатом стал сузетригин (Suzetrigine, также известный как VX-548, торговое название Journavx) — новый неопиоидный анальгетик, первый в своем классе препарат для лечения острой боли, одобренный FDA в январе 2025 года [45] (механизм действия — во врезке и на рис. 15).
Для опиоидных препаратов основная причина побочных эффектов — снижение чувствительности клеток из-за десенситизации рецепторов, что приводит к необходимости увеличения дозы и развитию зависимости. Блокирование Nav1.8 не вызывает подобного эффекта (по крайней мере, в течение 14 дней — срок проведения клинических испытаний препарата). В отличие от неселективных блокаторов натриевых каналов, таких как лидокаин, сузетригин почти не влияет на канал Nav1.5, который играет ключевую роль в работе сердца, что минимизирует риск развития сердечных аритмий. Но, конечно же, препарат еще слишком новый, чтобы делать далеко идущие выводы. Как было показано в главах об опиоидах и НПВП, даже высокоселективные средства могут обладать нежелательными явлениями, причем иногда совсем неожиданными, и чтобы это увидеть, необходимо оценить долговременные эффекты от лечения новым препаратом [47]. Отдельное беспокойство вызывает отсутствие успешных клинических исследований у конкурентов Vertex Pharmaceuticals, что говорит о непростой задаче по созданию селективных блокаторов натриевых каналов. Но мы определенно пожелаем им удачи.
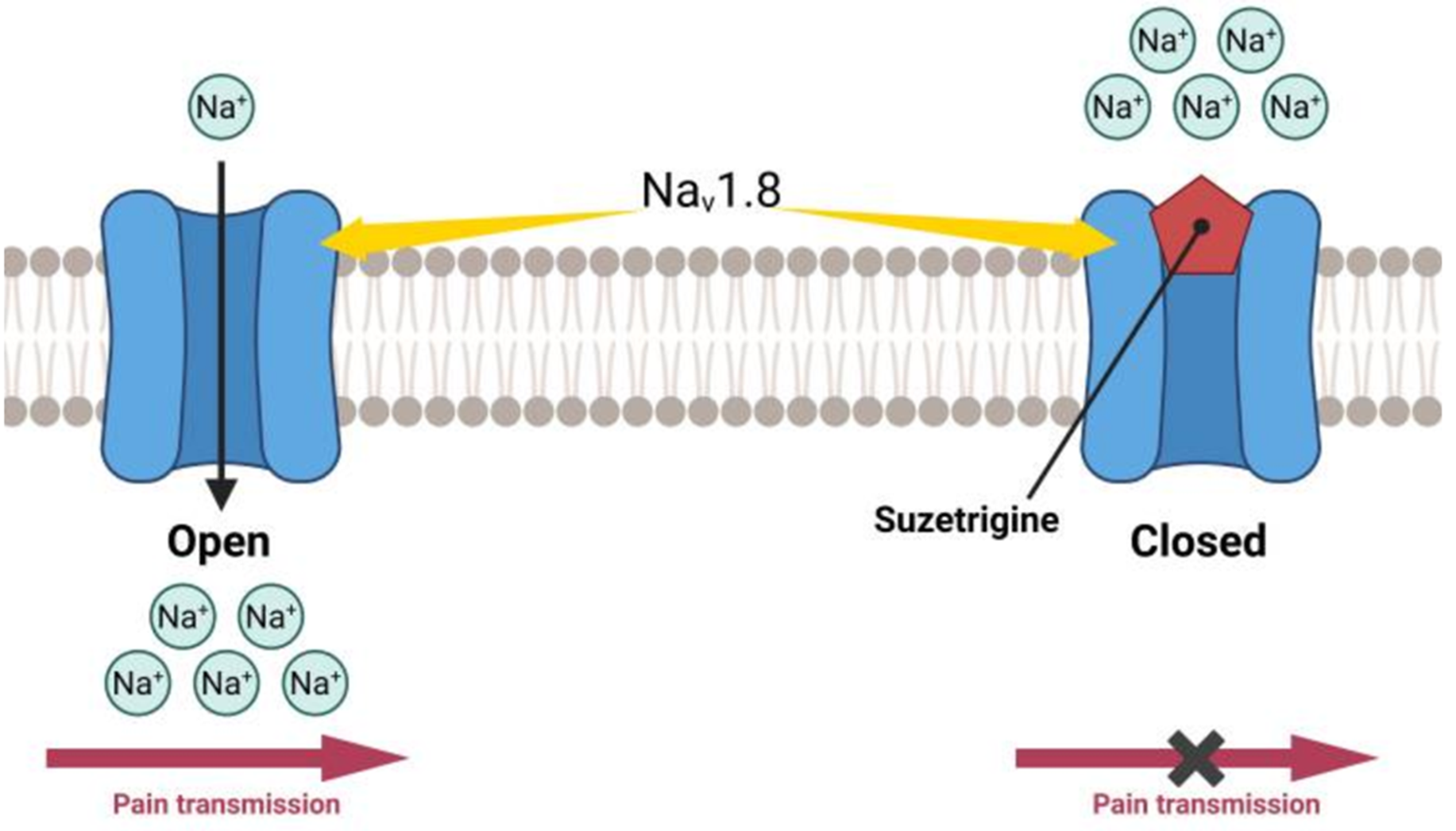
Рисунок 15. Одобрение сузетригина — это важный шаг в борьбе с опиоидным кризисом. Он предлагает новую, ненаркотическую альтернативу для лечения острой боли, что снижает риск развития зависимости у пациентов, перенесших хирургическое вмешательство или получивших травму. Именно Nav1.8 отвечают за передачу болевого сигнала, и сузетрегин блокирует этот канал селективно, не влияя на другие изоформы натриевых каналов.
Пуринорецепторы — следующие мишени анальгетиков?
Возможно, блокаторы Nav1.8 скоро станут не единственной сенсацией в мире анальгетиков. Рецепторы P2X3, о которых мы писали в одной из предыдущих глав, стали потенциальными мишенями для разработки новых лекарственных препаратов. В 2023 году на европейский рынок вышел препарат фирмы Merck & Co гефапиксант, который продается под торговой маркой Lyfnua и назначается для лечения хронического кашля. Да, этот препарат не является обезболивающим, но его появление отражает усилия, которые прикладываются для поиска анальгетика с принципиально новым механизмом действия. Препарат действует на периферическую нервную систему, а не на кашлевой центр в мозге, как кодеин или декстрометорфан (которые, кстати, относятся к опиоидам). Кроме того, в период проведения II фазы гефапиксант также проходил исследования для лечения боли при остеоартрите коленного сустава и синдрома боли в мочевом пузыре. Еще ряд препаратов — камлипиксант, сивопиксант и элиапиксант — находятся на разных стадиях клинических испытаний. Однако к этим препаратам всё еще остается ряд вопросов, которые касаются как эффективности, так и наличия разнообразных побочных эффектов. Из этого можно сделать вывод, что кашель и боль имеют общую природу: они запускаются схожими нейрохимическими механизмами передачи сигналов о повреждении в головной мозг, поэтому их можно эффективно подавлять через общие молекулярные «мишени», такие как опиоидные или пуринергические рецепторы.
Прямо сейчас разработка блокаторов пуринорецепторов резко поворачивает в новую область. В марте 2025 журнал Molecular Therapy опубликовал работу большой российской команды исследователей под руководством Александра Василевского из Института биоорганической химии в Москве [48]. В своей статье исследователи представили препарат PT-6 — антагонист пуринорецепторов P2X3: уникальный в своем роде пептид, обладающий преимуществами, которые могут составить конкуренцию, а может и обойти по эффективности препараты из группы «пиксантов».
Парадоксально, что источником PT-6 стали яд паука томизиуса (Thomisus onustus). В железах одного маленького паучка могут синтезироваться тысячи токсинов, большинство из которых чаще всего представляют собой пептиды или белки [49]. Многие миллионы лет естественный отбор «шлифовал» структуру этих веществ, которые стали самыми эффективными в природе лигандами к рецепторам животных. Благодаря такому разнообразию токсинов, пауки могут успешно охотиться и защищаться, а их яд действует на множество мишеней в организме жертвы. Молекулярная эволюция токсинов привела к созданию не только «убойных» ядов, но и веществ, обладающих анальгезирующими свойствами. Получилась своего рода линейка потенциальных препаратов, которой бы позавидовала любая фармкомпания. Пептиды, на которые обратили внимание авторы статьи, обладают сложной трехмерной структурой и избирательно блокируют P2X3 пуринорецепторы, описанные выше. О первом из такого рода пептидов (PT1) исследователи сообщали еще в 2000-х годах, а сейчас опубликовали результаты работы уже над новым препаратом, PT6 [50], [51]. Подробнее об этом исследовании «Биомолекула» недавно писала: «Лекарство из будущего: пептидный анальгетик на основе пуротоксина из яда паука» [52].
Прежде всего, PT6 — это пептид, обладающий высокой селективностью и эффективностью. Перечисленные выше «пиксанты» — это аналоги пуриновых нуклеотидов: по структуре напоминают АТФ, естественный лиганд этих рецепторов. Пуротоксины же имеют принципиально другое строение: эта сложная пептидная молекула, уложенная в уникальную трехмерную структуру, скрепленную дисульфидными мостиками; это позволяет им точно узнавать конкретные аминокислотные остатки в рецепторе и связываться с ними. Это значит, что пуротоксин может действовать целенаправленно на P2X3 и не влиять на другие изоформы рецептора. Надеемся, что у авторов получится довести свой препарат до клинических испытаний, ну а мы будем следить за развитием событий в этой области.
Препараты для лечения мигрени
Среди различных причин боли одна занимает особое место — головная боль при мигрени. И это не просто сильная головная боль, а комплексное нейрососудистое явление.
- Мигрень —
- неврологическое заболевание, которое проявляется приступами сильной, пульсирующей головной боли, часто с одной стороны головы. Боль может усиливаться при физической активности, а приступы могут сопровождаться тошнотой, рвотой, повышенной чувствительностью к свету и звукам. Такие приступы могут длиться от нескольких часов до нескольких дней.
Мигрень можно разделить на два основных клинических типа: без ауры и с аурой. Отличия заключаются в составе клинических признаков и молекулярно-биологических факторов восприимчивости, то есть тех триггеров, которые могут вызвать новый приступ. Зрительные, сенсорные или другие симптомы со стороны ЦНС обычно предшествуют головной боли, за первыми проявлениями следуют следующие симптомы мигрени (рис. 16). Помимо этих двух основных типов, известны и другие подтипы или формы, включая вестибулярную, глазную и/или абдоминальную мигрень. В зависимости от частоты приступов мигрень также подразделяется на хроническую и эпизодическую [53].
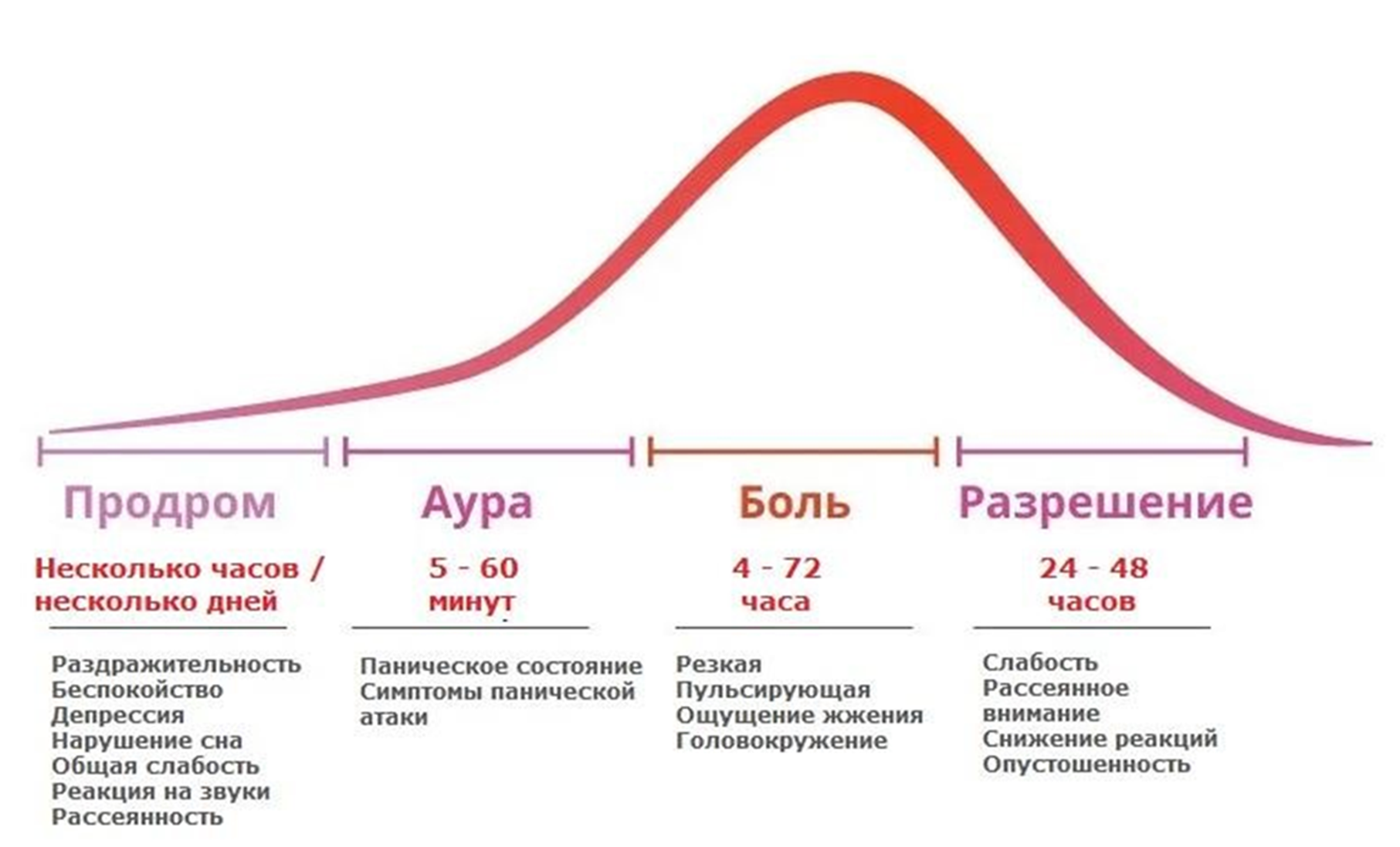
Рисунок 16. Полный цикл мигрени: четыре стадии нейрологического шторма. Обычно выделяют три или четыре фазы (в зависимости от наличия или отсутствия ауры): продромальную, фазу ауры, болевую и постдромальную.
Чем лечат мигрень
Для лечения мигрени в зависимости от тяжести приступов могут назначать препараты, которые снимают симптомы, но не имеют специфического эффекта на патогенез мигрени: НПВП-анальгетики, антидепрессанты, бета-блокаторы, блокаторы кальциевых каналов. Для купирования тошноты могут использоваться противорвотные средства, а для усиления анальгетического эффекта иногда добавляют кофеин.
Однако существуют препараты, обладающие специфическими эффектами при лечении мигрени. Среди них можно выделить специально разработанные для лечения острой мигрени, включая (1) агонисты 5-HT (серотониновых) рецепторов (триптаны и дитаны); (2) антагонисты рецептора CGRP; и (3) моноклональные антитела, блокирующие CGRP (табл. 3).
| Препарат | Показания | Механизм действия | Важные противопоказания | Дата одобрения FDA |
|---|---|---|---|---|
| Эра эрготаминов (алкалоиды спорыньи) | ||||
| Эрготамин | Острые приступы мигрени | Неселективный агонист 5-HT1B, 5-HT1D и 5-HT1F рецепторов | Ишемическая болезнь сердца | Использование с 1938, одобрен в 1976 |
| Дигидроэрготамин | 1946 | |||
| Эра триптанов-агонистов 5-HT1B/1D-рецепторов | ||||
| Суматриптан | Острые приступы мигрени | Селективный агонист | Ишемическая болезнь сердца | 1992 |
| Золмитриптан | 1997 | |||
| Наратриптан | 1998 | |||
| Ризатриптан | 1998 | |||
| Алмотриптан | Ишемическая болезнь сердца, нарушение функции печени и гиперчувствительность к сульфонильной группе | 2001 | ||
| Эра дитанов | ||||
| Ласмидитан | Острые приступы мигрени | Селективные агонисты 5-HT1F-рецепторов | Головокружение и парастезия | 2019 |
| Эра гепантов | ||||
| Уброгепант | Острые приступы | CGRP-рецептор | Аллергические реакции | 2019 |
| Римегепант | Острые приступы мигрени + профилактика | Долгосрочное исследование безопасности | 2020 | |
| Атогепант | Профилактика приступов | 2021 | ||
| Вазегепант | Острые приступы мигрени | 2023 | ||
| Эра моноклональных антител | ||||
| Эренумаб | Профилактика приступов | CGRP-рецептор | Непроходимость кишечника и сердечно-сосудистые риски | 2018 |
| Фреманезумаб | Сам пептид CGRP | 2018 | ||
| Галканезумаб | 2018 | |||
| Эптинезумаб | 2018 | |||
| Продолжение следует… | ||||
При этом стоит отметить, что в последние десять лет стало появляться больше препаратов, блокирующих CGRP или его рецептор, что говорит о сдвиге стратегии разработки препаратов против мигрени. Новые антагонисты рецепторов CGRP (гепанты) и агонисты 5-HT1F-рецепторов (дитаны) считаются перспективными альтернативами, учитывая их более высокую эффективность в сочетании с более мягкими побочными эффектами.
Моноклональные антитела при лечении мигрени
Всего несколько лет назад лечение мигрени вышло на новый уровень: в 2018 году в США были одобрены первые моноклональные антитела для лечения мигрени (табл. 3); в России первый препарат этого класса появился в 2020 году. Моноклональные антитела блокируют либо сам CGRP, либо его рецептор, предотвращая их связывание и не допуская расширение кровеносных сосудов, из-за которого происходит головная боль при мигрени.
Первыми препаратами для лечения мигрени стали Аймовиг (эренумаб), ингибитор рецептора CGRP (подробности: «„Аймовиг“ — спасение от мигрени?» [55]); и Аджови (фреманезумаб), который связывается и блокирует эффект самого пептида CGRP. Исследования реальной клинической практики подтверждают высокую эффективность обоих препаратов, в том числе и у пациентов, трудно поддающихся традиционной терапии. Особенностью препаратов стал их профилактический эффект, они вводятся один раз в месяц и не допускают развитие новых приступов в этот период. Однако такое лечение гораздо дороже лечения триптанами: средняя цена в России 22 000–24 000 рублей за одну инъекцию. Другое антитело — галканезумаб (Эмгалити) — одобрено для профилактического лечения мигрени у взрослых (2018) и для лечения эпизодической кластерной головной боли (2019). Также в 2020 году FDA одобрило эптинезумаб (Vyepti), который отличается более продолжительным действием и вводится раз в три месяца (в России одобрен в 2024 году).
В настоящее время исследования препаратов против мигрени продолжаются. Помимо моноклональных антител против CGRP и его рецептора, исследуется еще один нейропептид, связанный с развитием мигрени, — PACAP (полипептид, активирующий аденилатциклазу гипофиза). Ведутся клинические испытания PACAP-ингибиторов, которые могут стать новым классом препаратов для профилактики мигрени.
Заключение
Борьба с болью остается острой проблемой медицины. Как показано в статье, прогресс в нашем понимании молекулярных механизмов ноцицепции — от ионных каналов TRP, ASIC и P2X до роли CGRP в развитии мигрени — открывает для нас новые терапевтические горизонты. Несмотря на это, опиоиды всё еще остаются основным классом анальгетиков при хронической и сильной острой боли. Увы, высокий риск зависимости — это та цена, которую мы платим за использование этих препаратов.
К счастью, активные доклинические и клинические исследования прокладывают путь к созданию новых поколений анальгетиков. Разработка новых препаратов селективных модуляторов, таких как сузетригин, антагонисты пуринорецепторов и новые классы препаратов для направленного лечения мигрени, демонстрирует переход к более персонализированным и безопасным подходам к обезболиванию. Хотя путь от лабораторных открытий до рынка долог и сложен, непрерывные научные изыскания вселяют надежду на будущее, где миллионы людей, страдающих от хронической боли, смогут получить эффективное и безопасное лечение, значительно улучшающее качество их жизни.
Литература
- Marcin Karcz, Alaa Abd-Elsayed, Krishnan Chakravarthy, Aman Mansoor, Natalie Strand, et. al.. (2024). Pathophysiology of Pain and Mechanisms of Neuromodulation: A Narrative Review (A Neuron Project). JPR. Volume 17, 3757-3790;
- Sonika Charak, Robin George Thattil, Chandra Mohan Srivastava, Prabhu Prasad Das, Manish Shandilya. (2021). Assessment and Management of Pain in Palliative Care. Suggestions for Addressing Clinical and Non-Clinical Issues in Palliative Care;
- Ликбез по ЦНС;
- Marco Cascella, Maria Rosaria Muzio, Federica Monaco, Davide Nocerino, Alessandro Ottaiano, et. al.. (2022). Pathophysiology of Nociception and Rare Genetic Disorders with Increased Pain Threshold or Pain Insensitivity. Pathophysiology. 29, 435-452;
- Молекулярная биология боли;
- Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021);
- Kareem Alalami, Jenna Goff, Hannah Grimson, Oliver Martin, Eloise McDonald, et. al.. (2024). Does Topical Capsaicin Affect the Central Nervous System in Neuropathic Pain? A Narrative Review. Pharmaceuticals. 17, 842;
- Geoffrey Burnstock. (2008). Purinergic signalling and disorders of the central nervous system. Nat Rev Drug Discov. 7, 575-590;
- Жгучий перец облегчит боль;
- «Мятный холодок»: почему ментол создаёт ощущение прохлады во рту;
- Miao Zhang, Yueming Ma, Xianglu Ye, Ning Zhang, Lei Pan, Bing Wang. (2023). TRP (transient receptor potential) ion channel family: structures, biological functions and therapeutic interventions for diseases. Sig Transduct Target Ther. 8;
- Nasser Abdullah, Christophe Altier. (2020). TRPV1 and MOR working in tandem: implications for pain and opioids use. Neuropsychopharmacol.. 45, 225-226;
- Yaroslav A. Andreev, Sergey A. Kozlov, Sergey G. Koshelev, Ekaterina A. Ivanova, Margarita M. Monastyrnaya, et. al.. (2008). Analgesic Compound from Sea AnemoneHeteractis crispaIs the First Polypeptide Inhibitor of Vanilloid Receptor 1 (TRPV1). J. Biol. Chem.. 283, 23914-23921;
- Aleksandra N. Kvetkina, Sergey D. Oreshkov, Pavel A. Mironov, Maxim M. Zaigraev, Anna A. Klimovich, et. al.. (2024). Sea Anemone Kunitz Peptide HCIQ2c1: Structure, Modulation of TRPA1 Channel, and Suppression of Nociceptive Reaction In Vivo. Marine Drugs. 22, 542;
- Emmanuel Deval, Xavier Gasull, Jacques Noël, Miguel Salinas, Anne Baron, et. al.. (2010). Acid-Sensing Ion Channels (ASICs): Pharmacology and implication in pain. Pharmacology & Therapeutics. 128, 549-558;
- Dmitry I. Osmakov, Sergey A. Kozlov, Yaroslav A. Andreev, Sergey G. Koshelev, Nadezhda P. Sanamyan, et. al.. (2013). Sea Anemone Peptide with Uncommon β-Hairpin Structure Inhibits Acid-sensing Ion Channel 3 (ASIC3) and Reveals Analgesic Activity. Journal of Biological Chemistry. 288, 23116-23127;
- Вторая жизнь АТФ: от главной батарейки до нейромедиатора;
- Осторожно, папарацци! Или как «сфотографировать» GPCR в комплексе с G-белком и лигандом;
- Sarah Bourne, Andre G. Machado, Sean J. Nagel. (2014). Basic Anatomy and Physiology of Pain Pathways. Neurosurgery Clinics of North America. 25, 629-638;
- Katherine T. Martucci, Sean C. Mackey. (2018). Neuroimaging of Pain. Anesthesiology. 128, 1241-1254;
- David Borsook, Richard Hargreaves, Chas Bountra, Frank Porreca. (2014). Lost but making progress—Where will new analgesic drugs come from?. Sci. Transl. Med.. 6;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- Md. Mahbubur Rahman, Sung-Min Hwang, Eun Jin Go, Yong Ho Kim, Chul-Kyu Park. (2024). Irisin alleviates CFA-induced inflammatory pain by modulating macrophage polarization and spinal glial cell activation. Biomedicine & Pharmacotherapy. 178, 117157;
- С миру по нитке: как соединились компоненты клинического исследования;
- Весь мир — большая лаборатория: что такое RWD и RWE, и как они помогают контролировать лекарства;
- Лекарства от психических расстройств: как не сойти с ума в эпоху современной фармакологии?;
- Фармакофоры нейропластичности;
- Patil Armenian, Kathy T. Vo, Jill Barr-Walker, Kara L. Lynch. (2018). Fentanyl, fentanyl analogs and novel synthetic opioids: A comprehensive review. Neuropharmacology. 134, 121-132;
- Tao Che, Bryan L. Roth. (2023). Molecular basis of opioid receptor signaling. Cell. 186, 5203-5219;
- Brian Reed, Eduardo R Butelman, Mary Jeanne Kreek. (2017). Endogenous opioid system in addiction and addiction-related behaviors. Current Opinion in Behavioral Sciences. 13, 196-202;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Структуры рецепторов GPCR «в копилку»;
- Аденозиновые рецепторы: история великого обмана;
- Abdelfattah Faouzi, Balazs R. Varga, Susruta Majumdar. (2020). Biased Opioid Ligands. Molecules. 25, 4257;
- Аллостерические регуляторы GPCR: ключи от всех замков;
- Идеальный опиоид, или Как избавиться от Дамоклова меча;
- Laura Rullo, Camilla Morosini, Antonio Lacorte, Marco Cristani, Flaminia Coluzzi, et. al.. (2024). Opioid system and related ligands: from the past to future perspectives. J Anesth Analg Crit Care. 4;
- Jie Ju, Zheng Li, Jie Liu, Xiaoling Peng, Feng Gao. (2025). Biased Opioid Receptor Agonists: Balancing Analgesic Efficacy and Side-Effect Profiles. IJMS. 26, 1862;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Ибупрофен: расширение горизонтов применения — от стандарта к инновациям;
- Minhajul Arfeen, Ashish Srivastava, Noopur Srivastava, Riaz A. Khan, Suliman A. Almahmoud, Hamdoon A. Mohammed. (2024). Design, classification, and adverse effects of NSAIDs: A review on recent advancements. Bioorganic & Medicinal Chemistry. 112, 117899;
- S. Bacchi, P. Palumbo, A. Sponta, M.F. Coppolino. (2012). Clinical Pharmacology of Non-Steroidal Anti-Inflammatory Drugs: A Review. AIAAMC. 11, 52-64;
- Edmundas Kaduševičius. (2021). Novel Applications of NSAIDs: Insight and Future Perspectives in Cardiovascular, Neurodegenerative, Diabetes and Cancer Disease Therapy. IJMS. 22, 6637;
- Тетродотоксин — история элегантного убийцы;
- Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер;
- Maciej Mach, Aleksandra Giba, Milosz Miedziaszczyk, Adrian Bryla, Danuta Szkutnik-Fiedler. (2025). Suzetrigine as a Novel Non-opioid Analgesic Drug in Pain Management: A Review of Clinical Evidence and Therapeutic Perspectives. Cureus;
- Meaghan Jones, Aryanna Demery, Rami A. Al-Horani. (2025). Suzetrigine: A Novel Non-Opioid Analgesic for Acute Pain Management—A Review. DDC. 4, 32;
- Peter Oparin, Oksana Khokhlova, Aleksandr Cherkashin, Kirill Nadezhdin, Victor Palikov, et. al.. (2025). Potent painkiller from spider venom antagonizes P2X3 receptors without dysgeusia. Molecular Therapy. 33, 771-785;
- Великому комбинатору и не снилось: комбинаторика токсинов пауков;
- Oleg O. Krishtal. (2009). Novel peptide from spider venom inhibits P2X3 receptors and inflammatory pain. Ann Neurol.. NA-NA;
- Peter Oparin, Oksana Khokhlova, Aleksandr Cherkashin, Kirill Nadezhdin, Victor Palikov, et. al.. (2025). Potent painkiller from spider venom antagonizes P2X3 receptors without dysgeusia. Molecular Therapy. 33, 771-785;
- Лекарство из будущего: пептидный анальгетик на основе пуротоксина из яда паука;
- Kofi Frimpong-Manson, Yuma T. Ortiz, Lance R. McMahon, Jenny L. Wilkerson. (2024). Advances in understanding migraine pathophysiology: a bench to bedside review of research insights and therapeutics. Front. Mol. Neurosci.. 17;
- Farzin Zobdeh, Aziza ben Kraiem, Misty M. Attwood, Vladimir N. Chubarev, Vadim V. Tarasov, et. al.. (2021). Pharmacological treatment of migraine: Drug classes, mechanisms of action, clinical trials and new treatments. British J Pharmacology. 178, 4588-4607;
- «Аймовиг» — спасение от мигрени?.