РНК-терапия: новая глава в истории медицины
03 октября 2025
РНК-терапия: новая глава в истории медицины
- 1266
- 0
- 10
РНК-терапия открывает новую главу в истории медицины, став одним из выдающихся достижений последних десятилетий. Основываясь на использовании различных типов молекул рибонуклеиновой кислоты, она избирательно управляет производством белков в организме, изменяя течение болезней на самом глубинном уровне.
Рисунок в полном размере.
-
Автор
-
Редакторы
-
Иллюстратор
В 1953 году, после того как Уотсон и Крик предложили модель двойной спирали ДНК, одной из центральных тайн молекулярной биологии оставался вопрос: как генетическая информация передается от «молекулы жизни» к функциональным компонентам клетки — белкам? Открытие матричной РНК — чрезвычайно важной молекулы-посредника — позволило сделать кардинальный шаг к его разгадке. Как выяснилось, она была своего рода «мессенджером», передавая зашифрованные в ДНК инструкции клеточным механизмам белкового синтеза. Казалось бы, какое простое (!) открытие… Однако кроме этого оказалось, что РНК не просто переносит информацию — это молекула с впечатляющим разнообразием форм и функций. Ее лабильность, ферментативная активность и способность к генной регуляции указывали на исключительное значение в клеточных процессах.
В этом обзоре раскрываем удивительную роль РНК в патогенезе заболеваний, представляя хронологию развития РНК-терапии: от первых гипотез до клинического применения. Вы узнаете о ключевых прорывах в этой области, различных платформах на основе РНК, их механизмах действия, преимуществах и недостатках. Особое внимание уделим уже одобренным терапиям, а также перспективным лекарствам, проходящим клинические испытания. Почему мРНК-вакцины, препараты РНК-интерференции и антисенсы стали основными трендами в этой области? Как они купируют патологические процессы? Обо всем этом — в нашей статье.
Генная и клеточная терапии

Четвертый сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
РНК-терапия — динамично развивающееся направление современной медицины, основанное на использовании различных типов молекул рибонуклеиновой кислоты для направленной регуляции продукции белков, участвующих в развитии патологий. Она обладает рядом уникальных преимуществ, делающих ее одним из перспективных направлений биомедицины. В то время как низкомолекулярные лекарственные препараты чаще всего направлены на взаимодействие с уже существующими белковыми структурами организма, РНК-терапия напрямую влияет на аппарат биосинтеза клетки, что в корне отличается от традиционных схем лечения. Вмешиваясь в сам процесс создания новых белков, РНК-лекарства позволяют точечно корректировать болезнь на более фундаментальном уровне — и делают это, не затрагивая ДНК (в отличие от многих генных терапий), что резко снижает риски генотоксичности.
Больше того, за счет универсального механизма комплементарности («спаривания» между основаниями), молекулы РНК теоретически могут воздействовать на работу любого интересующего гена ; а ввиду наличия различных РНК-платформ — делать это разными способами. Секрет здесь в том, что молекулы РНК не просто посредники между гено́мом и белками, а некая «программа», которую можно (и в медицинских целях ─ нужно) изменять. Например, малые интерферирующие РНК (siRNA) эффективно разрушают РНК-шаблоны для синтеза «патогенных» белков, останавливая болезнетворный механизм еще на старте. Антисмысловые олигонуклеотиды (они же антисенсы, или ASO) работают немного иначе: блокируя считывание дефектной генетической инструкции и не давая ей превратиться во «вредоносный» белковый продукт (рис. 1).
Зачастую это воздействие бывает опосредованным: например, через связывание с матричной РНК (рассказываем об этом далее).
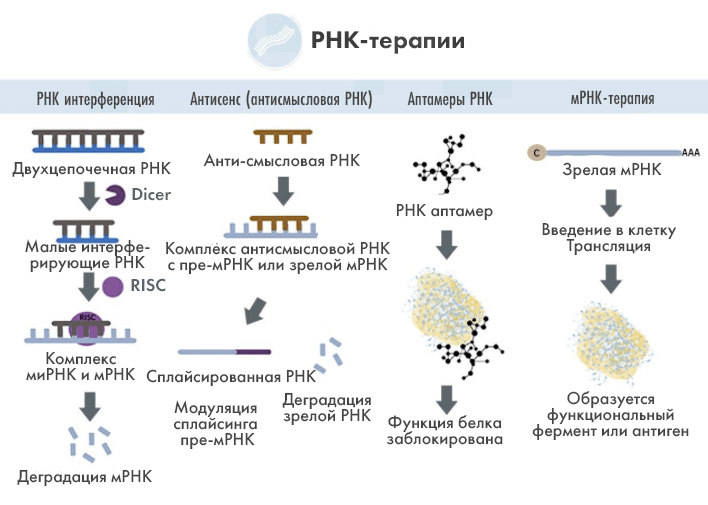
Рисунок 1. Сравнение базирующихся на РНК-молекулах терапий.
1) РНК-интерференция: в природе сначала фермент Dicer расщепляет двухцепочечную мРНК, разрезая ее на кучу малых интерферирующих молекул РНК (siRNA): об этом явлении ниже рассказываем подробнее; сами siRNA уже можно использовать в качестве терапевтических «агентов», синтезируя их искусственно, ─ они умеют связываться с мультибелковым комплексом RISC, который направляется затем на целевую мРНК, вызывая ее расщепление или ингибирование трансляции. Это прерывает сборку закодированных в ней белков, приводя к целевому терапевтическому эффекту.
2) Антисенсы ─ небольшие одноцепочечные молекулы РНК, комплементарные целевой мРНК. Связываясь с ней, они блокируют дальнейшее считывание генетической информации и ее перевод в белковую последовательность.
3) Аптамеры — это РНК, которые умеют связываться напрямую с белками, блокируя их активность с терапевтическими целями.
4) мРНК-терапия: нужные белки можно закодировать в мРНК, затем доставить ее в клетку, и вуаля: терапевтические белковые продукты будут биосинтезироваться по месту действия.
На этом рисунке продемонстрированы основные виды РНК-терапии, однако их больше — основанные на тРНК, микроРНК и на других типах РНК (рассказываем об этом ниже).
Если же следует, наоборот, запустить производство полезного белка, — тут может помочь мРНК-терапия — та самая технология, что легла в основу современных вакцин против COVID19. Клетке в этом случае будто «подбрасывают» готовый «чертеж», и она начинает собирать нужные белковые молекулы, следуя новому руководству [3].
Одним из важнейших преимуществ РНК-терапии является также относительная простота разработки, что выгодно отличает ее от трудоемкого процесса создания низкомолекулярных препаратов, зачастую требующего (помимо поиска нужной мишени) тестирования сотен химических соединений для поиска «идеальных» кандидатов на роль лекарств (так называемых «лидов») .
О том, как все это происходит, подробно рассказано в статье: «Драг-дизайн: как в современном мире создаются новые лекарства» [4].
Для разработки же РНК-терапии достаточно знать мишень, а уже дальше можно довольно оперативно синтезировать под нее нужную нуклеотидную последовательность. Это означает, что довести препарат до стадии производства, а затем (если конечно дело будет стоить того) вывести его на рынок будет быстрее и дешевле [5]. Разумеется, наряду с преимуществами здесь существуют трудности и вызовы, характерные для любого нового направления медицины: обо всем этом рассказываем далее.
История исследований: путь к разработке РНК-лечения
Нуклеиновые кислоты в центре внимания
Развитие РНК-терапии было бы немыслимо без крупных открытий фундаментальной молекулярной биологии. В 1869 году швейцарский физиолог Фридрих Мишер (рис. 2) обнаружил новую молекулу, открытие которой знаменовало начало новой эпохи — «века ДНК». В то время этот молодой еще ученый задался целью изучать «внутренний мир» клетки, прицельно сосредоточившись на ее химическом составе. Для исследований он использовал белые кровяные клетки, известные как лейкоциты. Эти маленькие защитники нашего организма особенно активно борются с инфекцией, поглощая различные патогены и скапливаясь в больших количествах там, где начинается воспаление. Чтобы набрать необходимое для анализа количество клеток, Мишер обращался за помощью к местным хирургам. Те регулярно приносили ученому свежеиспользованные бинты, пропитанные гноем пациентов — именно в этом необычном материале таились тысячи лейкоцитов, готовых делиться своими секретами.

Рисунок 2. Швейцарский физиолог, гистолог и биолог Фридрих Мишер.
Для начала Мишеру пришлось разработать методы промывания лейкоцитов и отделения цитоплазмы от ядер. В попытках анализировать выделенные из этих клеток белки и липиды, исследователь обнаружил вещество с неожиданными свойствами: при небольшом подкислении оно выпадало в осадок в виде белых нитей или хлопьев, но стоило добавить щелочь — вновь растворялось. Загадочная субстанция была названа «нуклеином», и Мишер тогда и не ведал, что впервые выделил ДНК [6].
В последующем открытие двойной спирали ДНК Уотсоном и Криком (а это произошло больше чем через 80 лет после опытов Мишера [7]) и формулирование центральной догмы молекулярной биологии установило матричную и линейную природу передачи информации в клетке: от ДНК к РНК и далее к белку. Такое уже вполне современное представление стало возможным лишь благодаря определению структур и функций нуклеиновых кислот, причем далеко не последнюю роль здесь сыграло изучение молекул РНК.
РНК на авансцене: первое приближение
Итак, открытие и исследование нуклеиновых кислот показало их важность для всех жизненных процессов (таких как рост, развитие и размножение) [8]; обнаружение же в 1961 году мРНК подчеркнуло особую значимость именно этой молекулы как ключевого посредника в передаче генетической информации (рис. 3).
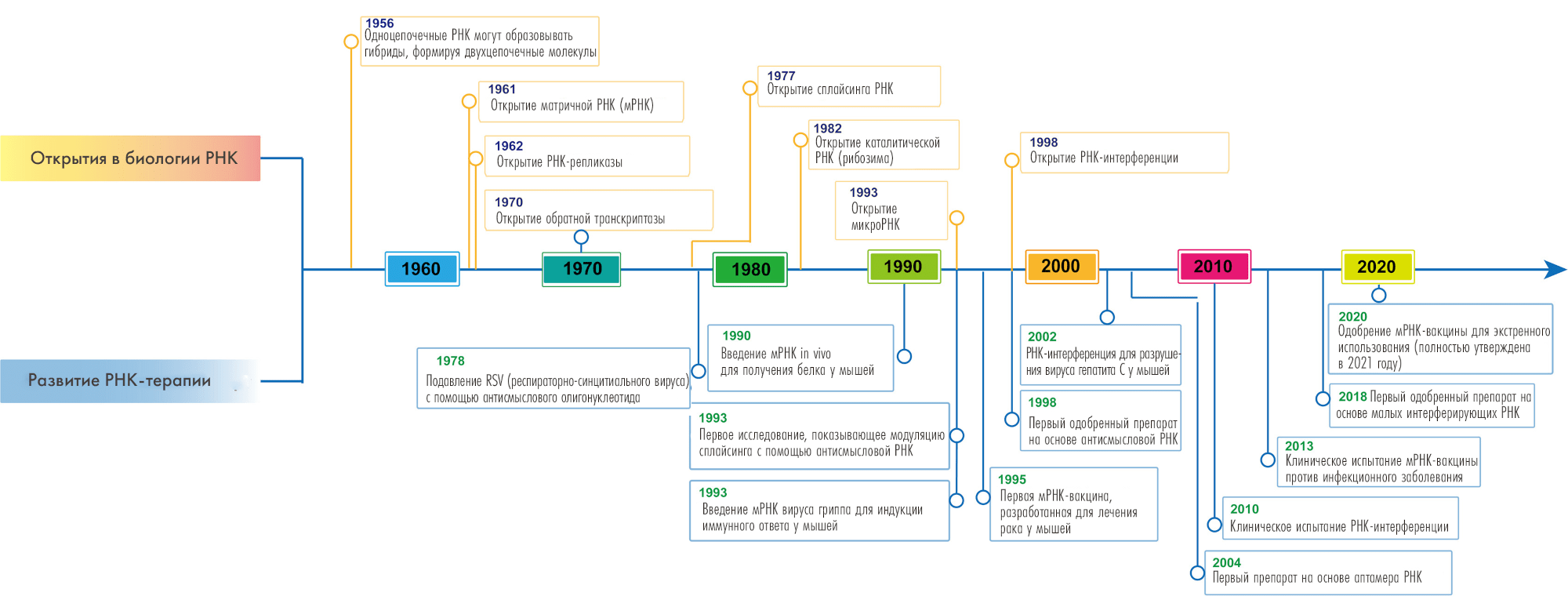
Рисунок 3. Краткая хронология открытий в области биологии РНК и их последующий вклад в развитие РНК-терапий.
Однако было и другое не менее важное (но менее обсуждавшееся) открытие, имевшее решающее значение для всей области РНК-терапии (и не только): а именно обнаружение того, что две РНК могут образовывать пары оснований друг с другом. Хотя сейчас уже это воспринимается как нечто само собой разумеющееся, раньше исследователи не верили, что РНК может образовывать двойную спираль [9]. В 1956 году американские биологи Александр Рич и Дэвид Р. Дэвис убедительно продемонстрировали такую возможность. Смешивая натриевые соли полиадениловой и полиуридиловой кислот, они с удивлением обнаружили, что получаемый раствор становится вязким. Анализируя под рентгеновскими лучами [10] полученное «желе», они отметили, что структура была характерной для спирали, и больше того — демонстрировала поразительное сходство с ДНК [11]. Новость об этом вызвала вполне ожидаемый скепсис среди коллег-биохимиков: «Без фермента?!» — с сомнением спросил один из них, не веря в такой результат. Дело в том, что в 1950-е соединение двух сложных биополимеров без участия ферментов-катализаторов считалось невозможным [12].
Тем не менее, вскоре стало ясно, что Рич и Дэвис совершили настоящий прорыв, впервые зафиксировав гибридизацию, — явление, метко окрещенное Джулианом Хаксли «молекулярным сексом» [13]. Гибридизация стала основой совершенно нового подхода к взаимодействию нуклеиновых кислот и открыла двери множеству важнейших технологий молекулярной биологии: от ДНК-микрочипов и антисенс-терапии (про нее ниже) до самых продвинутых технологий вроде CRISPR-Cas9. Сам факт образования пар ДНК–РНК сразу подсказывал: перенос генетической информации происходит именно в направлении между этими биополимерами — процесс, ныне известный как транскрипция [12].
То что ДНК может гибридизоваться с РНК, выявил экспериментально тот же Александр Рич. Смешивая молекулы синтетических ДНК и РНК, он увидел, что их взаимодействие дает комплекс, имеющий структуру двойной спирали. На этом основании он и предположил, что перенос генетической информации в живой клетке происходит как раз между этими двумя молекулами [14]. Больше об изучении нуклеиновых кислот в статье: «Выделяем нуклеиновые кислоты: эволюция методов» [7].
В 1978 году американские молекулярные биологи Пол Замечник и Мэри Стивенсон, опираясь на теперь уже всем известный феномен «молекулярного секса», показали, что такой вот «секс» способен (как это ни парадоксально!) прерывать размножение вирусов. Используя короткие нуклеотидные цепочки, они обнаружили, что при их связывании с последовательностями РНК-генома вируса саркомы Рауса происходит подавление его репликации. Стало понятно, что для свободного считывания информации смысловая нуклеиновая цепочка (то есть та, что несет в себе генетический «шифр») всегда должна быть «незанятой»; ну а если ранее с ней уже связалась какая-то комплементарная цепь (антисмысловая), дальнейшее копирование и передача генетической информации могут стать попросту невозможными.
Замечник такую технологию окрестил «антисмысловой», и спустя время она легла в основу создания препаратов-антисенсов [5] для лечения самых разных заболеваний. В дальнейшем по мере изучения ключевых этапов биосинтеза стало ясно, что считыванием со смысловой геномной цепи транскрипция вовсе не ограничивается; образовавшиеся мРНК затем подвергаются «созреванию»: их некодирующие участки (интроны) вырезаются, после чего оставшиеся кодирующие последовательности (экзоны) — сшиваются. Этот важнейший процесс известен нам теперь как сплайсинг, и отклонения в нем могут стать причиной разнообразных генетических сбоев и соответствующих им заболеваний.
В начале 1990-х команда американского биохимика польского происхождения Збигнева Домински выяснила, что если нацеливать антисмысловые нуклеотиды на определенные сайты сплайсинга, можно не только подавлять экспрессию генов, но и напротив — восстанавливать их нормальную работу [8]. Все эти непрекращающиеся исследования медленно, но верно подводили научную базу для создания современных антисенсов с самым разным механизмом действия (рис. 4).
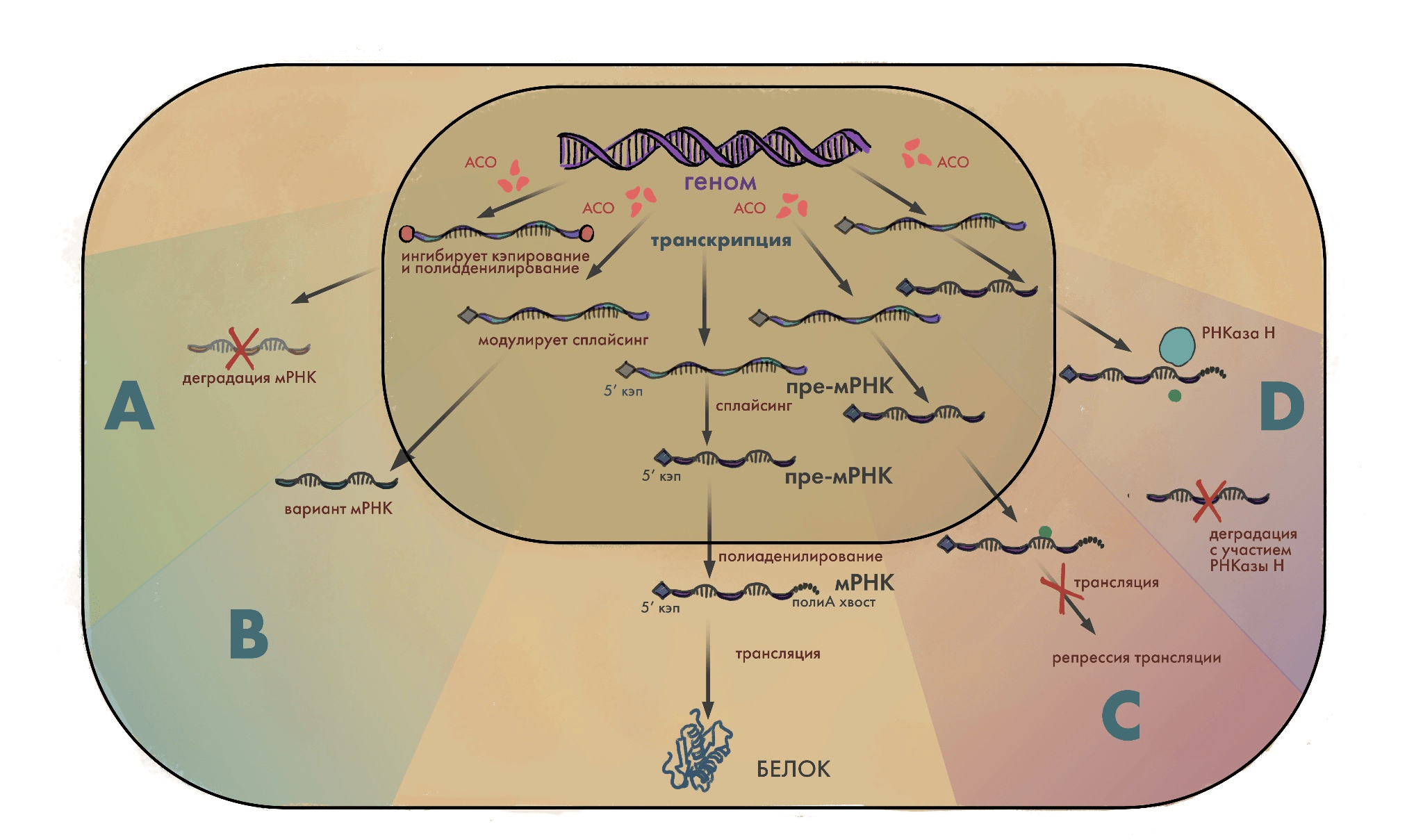
Рисунок 4. Разнообразие механизмов действия современных антисмысловых олигонуклеотидов. По центру схемы сверху вниз — нормальный биосинтез с передачей информации согласно центральной догме молекулярной биологии (ДНК → РНК → белок); по бокам — варианты вмешательства с помощью антисенсов на разных стадиях этого процесса. Связываясь по принципу комплементарности с (пре-)мРНК, они модулируют биосинтез следующими способами: А — ингибируют посттранскрипционные модификации (полиаденилирование и кэпирование) при созревании (процессинге) пре-мРНК; B — модулируют сплайсинг РНК; C — блокируют трансляцию; D — вызывают катализируемое ферментом РНКазой H расщепление РНК.
иллюстрация Елены Беловой из статьи «Генная терапия нейромоторных болезней» [15]
Феномен РНК-интерференции
В 1998 году американские ученые Эндрю Файр и Крейг Мелло сообщили об обнаруженном ими эффекте подавления экспрессии генов (сайленсинга) у нематоды Caenorhabditis elegans [16] при введении этому червю двухцепочечной РНК ─ открытие, которое они назвали РНК-интерференцией. Похожие явления наблюдали ранее у растений, но именно обнаружение сайленсинга у нематод позволило понять, как это работает. Постепенно стало ясно, что механизм подавления генов РНК-интерференцией ─ это эволюционно консервативный, естественный процесс. Ключевым моментом в его изучении стало открытие, что двухцепочечная РНК при введении в клетку расщепляется на более короткие РНК-фрагменты (рис. 5).
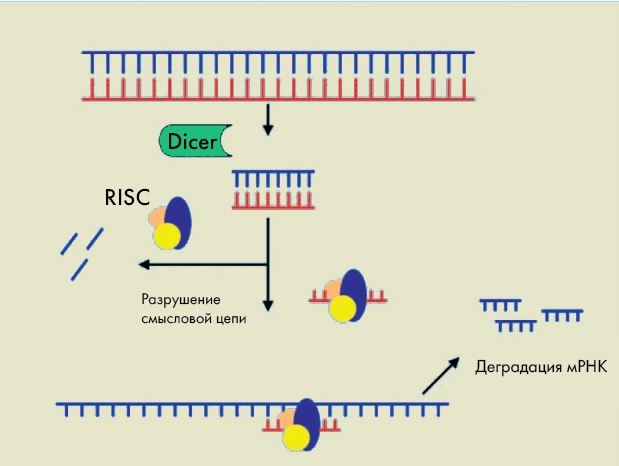
Рисунок 5. Механизм РНК-интерференции. Длинная двухцепочечная РНК расщепляется ферментом Dicer с образованием коротких интерферирующих молекул РНК. Образовавшиеся малые интерферирующие РНК (siRNA) связываются с мультибелковым комплексом, называемым RISC; при этом их смысловые цепи разрушаются, а антисмысловые начинают выполнять роль «гида», направляя комплекс RISC к целевой мРНК. Связывание RISC с мРНК приводит к ее расщеплению.
Эти малые интерферирующие РНК (siRNA) — короткие двухцепочечные молекулы, которые, связываясь с белковым комплексом, могут разрушать целевую мРНК, тем самым «выключая» экспрессию определенных генов. Этот процесс позже был обнаружен и у высших организмов, что показало универсальную роль механизма РНК-интерференции в регуляции генов.
Одним из ключевых событий стал эксперимент 2002 года, показавший, что siRNA может эффективно подавлять активность патогенных генов у мышей [18], что стало первым доказательством потенциального терапевтического применения этой технологии в живом организме. Это дало мощный импульс для дальнейшего развития идеи направленного блокирования генов .
За открытие механизмов РНК-интерференции Эндрю Файр и Крейг Мелло получили в 2006 году нобелевскую премию; а совсем недавно, в 2024 году американские ученые Виктор Эмброс и Гэри Равкун также стали нобелевскими лауреатами [19], но уже за «открытие микроРНК и ее роли в посттранскрипционной регуляции генов». МикроРНК ─ это молекулы, во многом схожие с siRNA; но вот только одноцепочечные, и в сравнении с siRNA они обладают более широким функционалом: воздействуя не только на РНК, но и на ДНК могут не только репрессировать, но и активировать экспрессию генов. Вообще, все это оказалось частью очень древних механизмов генной регуляции, о которой мы с каждым годом узнаем все больше, но пока еще очень далеки от раскрытия всех тайн. Подробнее об этом в статьях: «МикроРНК с огромным влиянием — за что вручили Нобелевскую премию по медицине (2024)» [19] и «Обо всех РНК на свете, больших и малых» [20].
Медленное развитие клинического применения: первые шаги
Так получилось, что препараты РНК поступили в терапевтическую практику далеко не сразу. Лишь спустя 20 лет после опытов Замечника, доказавших концепцию «антисмысла», Управление по контролю за продуктами и лекарствами США (FDA) одобрило самый первый препарат ASO для клинического применения (в 1998-м году). Это лекарство — Фомивирсен — представляло собой искусственно синтезированную 21-нуклеотидную цепочку, связывающуюся с комплементарной последовательностью мРНК цитомегаловируса (CMV) и блокирующую трансляцию белков, необходимых для его репликации. Средство использовалось для лечения цитомегаловирусного ретинита — серьезной инфекции сетчатки, способной привести к слепоте пациентов, страдающих СПИДом. Несмотря на терапевтическую эффективность, препарат довольно быстро сняли с рынка из-за успеха антиретровирусной терапии (см.: «Связанные одной лентой» [21]).
Тем не менее, Фомивирсен предоставил первое доказательство клинической ценности АSО [22]; а кроме того, это еще и был первый успешный кейс в преодолении одной из главных проблем РНК-лекарств — их нестабильности. Дело в том, что если доставлять в организм просто «голую» (немодифицированную) РНК, она будет очень быстро элиминирована: ферменты-нуклеазы просто расщепят ее на составляющие, которые затем будут утилизированы. Для преодоления этой природной напасти требовалось каким-то образом «прикрыть» нуклеотидную цепочку от «враждебных» нуклеаз, и первым рабочим вариантом стала химическая модификация нуклеотидов, примененная в Фомивирсене. В «торчащих» из нуклеотидов остатках фосфорной кислоты заменяли кислород серой, что сразу делало всю молекулу более стабильной, значительно увеличивая период ее полувыведения (о других «рабочих» вариантах защиты от нуклеаз будет сказано ниже).
К сожалению, сказать, что после данного успеха одобрения новых РНК-лекарств посыпались как из рога изобилия, значило бы очень сильно слукавить: скорее все было наоборот. В течение почти двадцати последующих лет на рынке появилось лишь несколько таких препаратов, а сама область оставалась не у дел с точки зрения массового коммерческого успеха.
Лишь в 2016 году несомненный успех Спинразы для лечения спинальной мышечной атрофии (СМА) вызвал новый всплеск интереса к подобным разработкам . За ним последовал ряд важных достижений, включая одобрение в 2018 году препарата Патисирана (Onpattro) — первого лечения на основе siRNA редкого заболевания — транстиретиновой амилоидной полинейропатии (подробнее об этом ниже). Параллельно с этими событиями ученые разрабатывали и другие варианты РНК-лекарств.
Дело в том, что этот препарат, в отличие от многих других антисенсов, оказался по-настоящему эффективным, причем от неизлечимой болезни с весьма и весьма печальным прогнозом. Поспорить в эффективности с ним смогла классическая генозаместительная терапия, а именно — препарат Золгенсма, также оказавшийся одним из самых эффективных в своем классе. Про оба этих лекарства мы писали уже не раз и не два: «Самое дорогостоящее лекарство в мире» [23], «СМА: три буквы — три лекарства» [24], «Есть ли смысл в антисенсах?» [5], «Надежда для СМАйликов» [25], «Генная терапия нейромоторных болезней» [15].
Первоначально мРНК-вакцины создавались для борьбы с гриппом, затем с раком; но здесь быстрого успеха достичь не удалось (новейшие разработки в этой области будут рассмотрены ниже). А вот по-настоящему «выстрелить» получилось только во время пандемии COVID-19, когда гонки за созданием эффективных вакцин настолько подстегнули разработку лекарств (да и всю фармацевтику), что наконец-то позволили вывести на рынок этот новый терапевтический подход. Первыми коммерчески успешными мРНК-вакцинами против ковида стали препараты от Moderna и Pfizer/BioNTech .
Тогда они помогали бороться с SARS-CoV-2, для чего доставляли в клетки РНК-цепочки, кодирующие антигены его поверхности ─ спайк-белки. Иммунные клетки запоминали этих «чужаков», в результате при заражении ковидом они были во всеоружии: срабатывавший иммунитет обеспечивал отсутствие симптомов при заражении (или протекание болезни в более легкой форме). Про вакцины от COVID-19 мы рассказывали в статьях: «Гонка во спасение: безопасны ли вакцины против коронавируса?» [26]; «Вакцины против коронавируса: перспективы» [27]; «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса» [28].
Что же, тут мы уже вплотную приблизились к современному этапу нашей истории — а это значит, пришло время поговорить о текущем состоянии РНК-терапии: клинических испытаниях наиболее перспективных лекарств; а также о тех, что уже одобрены к применению.
Status quo в РНК-терапии: клинические исследования и одобренные препараты
«Миры мРНК»
Если во времена ковидной пандемии наилучшим образом проявляли себя мРНК-вакцины против этого вируса, то сейчас использование подобных препаратов позволяет эффективно бороться далеко не только с инфекциями, демонстрируя неплохие результаты в борьбе с одной из главных угроз здоровью человечества. Речь об онкологических болезнях, перманентно занимающих «непочетное» второе место в структуре смертности развитых стран (печальную пальму первенства тут не менее прочно удерживают сердечнососудистые заболевания). Далее мы обсудим пример профилактической вакцины против одной инфекции, и также несколько лечебных препаратов на основе мРНК-технологий.
Вакцины против рака
Рассмотрим меланому кожи ─ злокачественную опухоль, развивающуюся из меланоцитов: один из самых агрессивных и устойчивых к лечению видов рака. Традиционные методы борьбы с ней, такие как хирургия, химиотерапия и лучевая терапия, могут помочь далеко не всегда, демонстрируя лишь ограниченную эффективность, что становится «особенно заметно» на поздних стадиях заболевания. Выручают многих из таких больных иммунологические терапии, в особенности с применением чекпойнт-ингибиторов (например, Пембролизумаба); их использование позволило значительно улучшить прогноз и выживаемость пациентов с метастазами. Однако и эти препараты далеко не универсальны, несмотря на их вполне себе выдающуюся эффективность: известно о снижении риска смертности аж на 40% у пациентов с метастатической меланомой (надо сказать, что это замечательные показатели для прежде почти безнадежных больных) [29].
Очевидно, потребность в действенном лечении здесь пока еще удовлетворена не полностью, но направление, в котором надо работать, как будто бы уже обозначено: иммунотерапия имеет множество способов воздействия на опухоль, и уже демонстрирует превосходные результаты. По всей видимости, именно так и подумали ученые, решив испытать еще одну иммунологическую стратегию: применить против рака неоантигенные РНК-вакцины.
Про ингибиторы контрольных точек мы рассказывали в статьях: «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [30]; «Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018)» [31].
Неоантигенными они называются потому, что для выработки иммунитета против рака используют собственно… неоантигены. Подвергаясь постоянным мутациям, опухоли биосинтезируют продукты видоизмененных этими мутациями генов, и вот они уже могут узнаваться клетками иммунной системы. Узнавание такое вполне закономерно должно приводить к уничтожению опухолевых клеток, но вот только загвоздка в том, что опухоли научились ускользать от иммунитета. Решить эту «маленькую» проблему собственно и призваны вакцины нового поколения: ведь продукты мутировавших генов вполне можно воспроизвести искусственно. Для этого достаточно «прочитать» (отсеквенировать) опухолевый геном, определить в нем мутантные последовательности, затем синтезировать их в форме РНК-цепочек и доставить в клетки человека инъекцией: в виде вакцины, содержащей кодирующие эти самые неоантигены транскрипты.
Попав в клетки, РНК-последовательности будут «взяты в оборот» машиной белкового синтеза, что приведет по итогу к их экспрессии (воспроизводству закодированных в них антигенов). Ну а последние «не оставят без внимания» уже клетки иммунной системы: на этой стадии механизм действия будет во многом схож с тем, как работают обычные вакцины. Познакомившись с антигенами, клеточные «бойцы иммунного фронта» будут искать и уничтожать уже их «владельцев» ─ клетки опухолей. (Все это лишь теория, а чуть ниже о том, как проявляют себя неоантигенные вакцины на практике: в клинических испытаниях.)
Поскольку молекулярно-генетическая гетерогенность опухолевых клеток крайне высока (за счет разнообразных мутаций), данная терапия должна быть персонализированной. То есть образцы опухолевой ткани для определения неоантигенов необходимо отбирать всякий раз для каждого нового пациента (рис. 6).
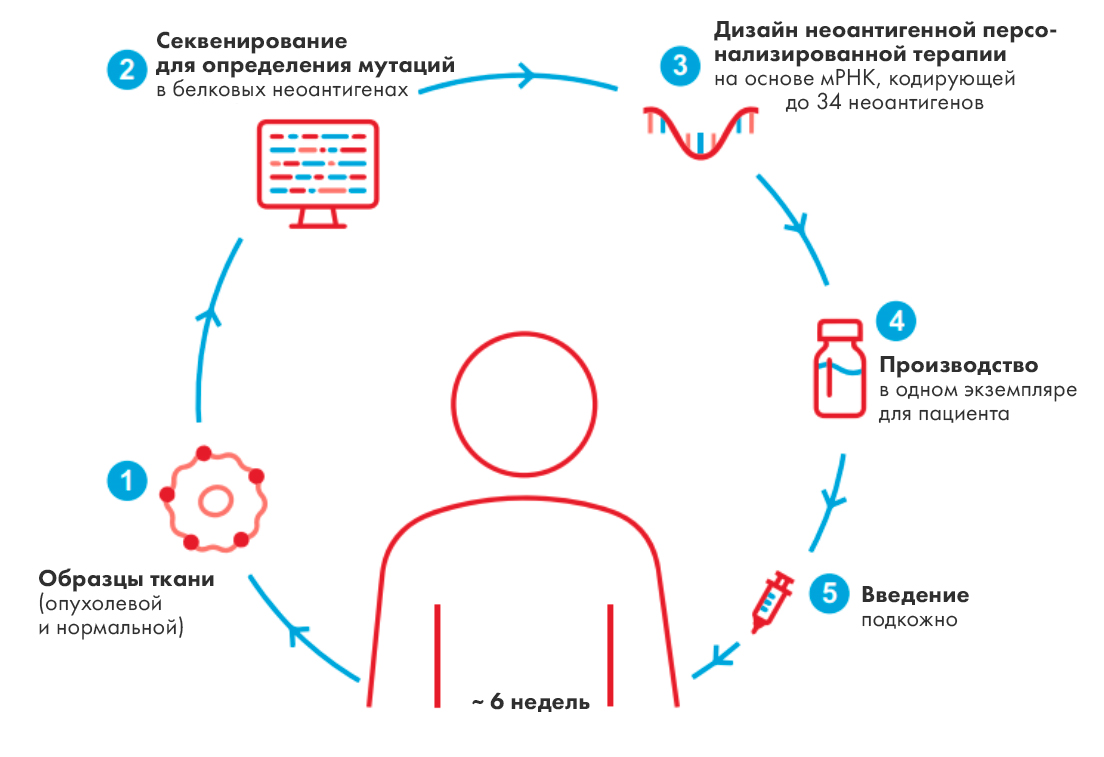
Рисунок 6. Схема изготовления персонализированной неоантигенной вакцины.
[32], рисунок адаптирован
Наиболее примечательные разработки таких препаратов проводятся сейчас теми же компаниями, что когда-то мощно выстрелили с антиковидными вакцинами: это Moderna и BioNTech; а разрабатываемые ими терапии известны под кодовыми названиями mRNA-4157 и BNT111 (также BNT122), соответственно. Данные об изучении этих продвинутых лекарств представлены ниже.
Данные клинических испытаний
В исследовании KEYNOTE-942 фазы IIb оценивалась комбинация mRNA-4157 и Пембролизумаба в сравнении с применением только лишь Пембролизумаба у пациентов с полностью вырезанной (резецированной) меланомой. Результаты выявили, что безрецидивная выживаемость и выживаемость без метастазов в целом были выше в группе получавших вакцину, чем у пациентов, лечившихся только Пембролизумабом; при этом отношение рисков рецидива было меньше единицы (0,561) [33], что говорит о значимом преимуществе такой терапии. Особо впечатлил тот факт, что риски возвращения опухолей в группе комбинированной терапии снижались почти вдвое в сравнении с группой монотерапии (22% против 40%), а 18-месячная выживаемость увеличивалась с 62% до 79%.
Стоит отметить, что и профили безопасности были сопоставимыми: нежелательные явления регистрировались с примерно одинаковой частотой в обеих испытуемых группах. Исследователи предполагают, что неоантигены из mRNA-4157 смогли усилить терапию ингибиторами контрольных точек за счет повышения степени активации иммунного Т-клеточного ответа [34].
В исследовании фазы I KEYNOTE-603 продолжили оценивать все ту же персонализированную терапию mRNA-4157 для пациентов с полностью резецированной меланомой II–IV стадий. Разница была лишь в том, что вакцина здесь уже использовалась не только в комбинации с Пембролизумабом, но и в качестве самостоятельного лечения. Исследование это в целом подтвердило результаты из KEYNOTE-942, показав аналогичные клинически важные преимущества и профили безопасности. Помимо «повторения пройденного», ученые изучили здесь и иммуногенность, отметив повышение уровня цитокинов, участвующих в развитии иммунитета, включая гамма-интерферон и фактор некроза опухоли альфа (TNF-α), что еще раз говорило о стимуляции специфичных реакций Т-клеточного иммунитета.
Что касается BNT111, ─ это лечение сейчас оценивается в текущем исследовании фазы II, и по известным данным оно показало индукцию как CD4+, так и CD8+ Т-клеточного ответа у 78% пациентов с меланомой как отдельно, так и в комбинации с Цемиплимабом (это также ингибитор контрольных точек с похожим на Пембролизумаб механизмом действия). Кстати, другой кандидат от BioNTech ─ вакцина BNT122 ─ тоже продемонстрировала активацию неоантиген-специфических Т-клеточных ответов у 50% пациентов (но уже при лечении другого заболевания ─ протоковой аденокарциномы поджелудочной железы [35]) в исследовании фазы I [36].
Все эти данные показывают, что такие вакцины обладают большим потенциалом: по-видимому, мРНК действительно умеет «обучать» иммунную систему распознавать рак для его последующего уничтожения. Если дальше будет демонстрироваться такая же эффективность, это даст повод для одобрения к применению; а значит и рекомендаций к использованию пациентами со сложным и/или запущенным течением заболеваний (и улучшению прогноза их лечения).
Одобренная вакцина от РСВ: многообещающая, но «неуспешная»
mRESVIA — новая мРНК-вакцина Moderna для профилактики заражения респираторно-синцитиальным вирусом (РСВ) у взрослых. Вирус этот может провоцировать широкий спектр респираторных проблем: от легких инфекций верхних дыхательных путей (они наиболее распространены) до опасных для жизни инфекций нижних дыхательных путей. Младенцы младше шести месяцев в особой группе риска — они подвержены развитию серьезных (и даже смертельных) осложнений.
Вирус также вызывает тяжелые расстройства у пожилых людей и лиц с фоновыми хроническими заболеваниями . При этом вакцин, эффективно защищающих младенцев и пожилых людей от РСВ, совсем недавно еще не существовало [37]; их пытались создать в 1960-х, но сделали только хуже — у вакцинированных заболевание протекало существенно хуже, двое детей умерло [38].
160 000 госпитализаций и 10 000 смертей среди взрослых в возрасте старше 65 лет только в США ежегодно [37].
Механизм действия mRESVIA аналогичен используемому в вакцине Moderna от COVID-19, только здесь транскрипт кодирует уже гликопротеин F вируса РСВ, что и позволяет вызывать сильный иммунный ответ на РСВ-инфекцию. В клинических испытаниях эта вакцина показывала защитную эффективность около 80% в первичном анализе (через 3,7 месяца), что вообще-то выглядит многообещающе; однако уже через 18 месяцев этот показатель снизился лишь до 50%, что уже заметно хуже, чем у конкурентов — субъединичных вакцин Arexvy (GSK) и Abrysvo (Pfizer). Вакцина от GSK сохраняла стабильную эффективность через 23,3 месяца, демонстрируя 68% защиты, в то время как вакцина Pfizer обеспечивала защиту в 78% через 16,4 месяца [39].
mRESVIA имеет хороший профиль безопасности с умеренными нежелательными явлениями (боли в месте инъекции, утомляемость), но уже очевидно насколько сильно она проигрывает «конкурирующим фирмам». Основная проблема — собственно быстрое снижение иммунного ответа, что и делает ее менее привлекательной; особенно в условиях, когда GSK и Pfizer со своими вакцинами (вышедшими за год до mRESVIA) успели уже захватить значительную долю рынка (рис. 7).
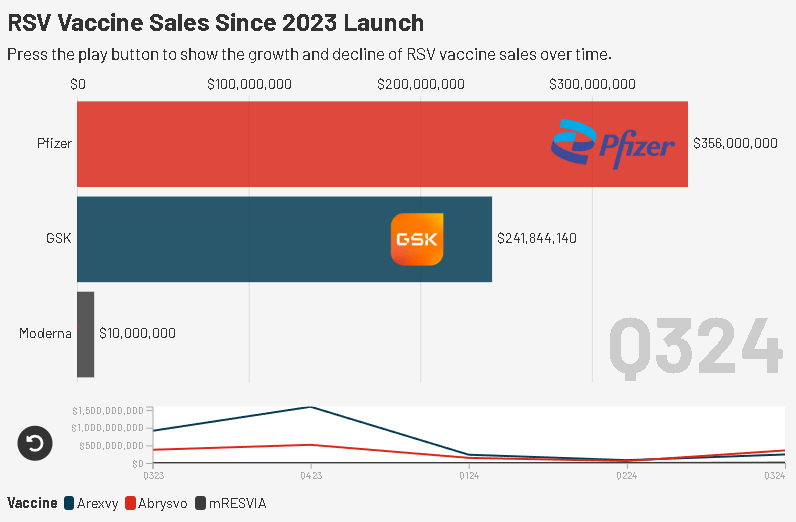
Рисунок 7. Сравнение долей рынка вакцин от РСВ.
Больше того, FDA одобрили mRESVIA только для лиц в возрасте от 60 лет и старше, в то время как конкуренты также изучают применение своих вакцин у беременных женщин (для защиты новорожденных). У Abrysvo уже есть хорошие данные по этому показанию, благодаря чему для этих целей ее успели одобрить для использования в Европе, Великобритании и США [40].
По итогу: несмотря на некоторую клиническую эффективность и одобрение, mRESVIA рискует так и остаться в тени доминирующих Arexvy и Abrysvo, что для Moderna, на фоне несомненного успеха ее вакцины против COVID-19, по видимому, обернется коммерческим провалом.
Не вакцинами едиными
мРНК-технологии могут не только «подстегивать» иммунитет, но и работать по сходному со способом действия классической генозаместительной терапии механизму: доставляя в клетку «чертежи» недостающих при заболевании белков. Например, ARCT-032 от Arcturus Therapeutics представляет собой препарат для лечения муковисцидоза ─ заболевания, при котором мутации в гене CFTR приводят к образованию густой слизи, нарушающей работу легких и поджелудочной железы. Происходит так потому, что функции белка CFTR заключаются в регуляции транспорта ионов и поддержании нормального состояния слизистых. Нарушение работы этого важного регулятора может приводить к закупорке бронхов, сопутствующим инфекциям, различным воспалениям и прогрессирующему повреждению легких вплоть до дыхательной недостаточности (это заболевание зачастую сокращает и продолжительность жизни). От последствий данной болезни во всем мире страдают порядка 105 тыс. человек; при этом около 15% из них не получают достаточную пользу от стандартных модуляторов работы CFTR (либо из-за наследственного отсутствия необходимого количества данного белка-регулятора, либо из-за непереносимости применяемых лекарств) .
О том, как разработка малых молекул-регуляторов функций CFTR когда-то смогла радикально улучшить прогноз и продолжительность жизни при муковисцидозе (а также подробности о патогенезе этой болезни) читайте в статье: «Муковисцидоз — первые надежды» [41].
ARCT-032 — это ингаляционный мРНК-препарат, предназначенный для восстановления нормальной функции CFTR в клетках легких. Ингаляционный метод введения имеет ряд преимуществ: в отличие от многих методов генной терапии, он не требует инъекций. Такой инновационный подход может помочь тем пациентам с муковисцидозом, у которых другое лечение попросту не сработало.
FDA уже присвоило этому препарату статус орфанного. Экспрессия полностью рабочего гена CFTR способна восстанавливать активность кодируемого им белка, предотвращая развитие сопутствующих хронических заболеваний, что сможет значительно улучшать качество жизни пациентов (пока только в теории). Орфанный статус присваивается тем препаратам, которые разрабатываются для профилактики и лечения редких заболеваний, что предоставляет компаниям особые преимущества [42]: эксклюзивность на рынке в течение семи лет после регистрации, право на налоговые льготы в течение клинических испытаний и некоторые другие «плюшки».
В то же время позитивные результаты исследований этого препарата показаны пока в основном в доклинических исследованиях (на животных: грызунах, хорьках и приматах) [43], а вот насколько хорош будет ARCT-032 в текущем клиническом испытании фазы II и далее ─ пока под вопросом.
Препараты РНК-интерференции
Лекарства от Alnylam
Начнем рассказ о препаратах РНК-интерференции с Alnylam Pharmaceuticals ─ это своего рода локомотив для данных технологий: компания постепенно внедряет в клиническую практику все больше таких лекарств, предлагая эффективные решения для заболеваний, долгие годы остававшихся неизлечимыми. Возьмем, к примеру, наследственный транстиретиновый амилоидоз (hATTR) — редкое, но тяжелое системное заболевание, при котором мутантный белок транстиретин (TTR) образует токсичные амилоидные отложения в основном в вегетативных и периферических нервах, но также в почках, сердце, и в других органах [44]. Весь этот патогенез зачастую приводит к весьма печальным последствиям, нередко трагическим и фатальным …
Лечение для данной болезни, конечно же, существует, но вот только имеет весьма ограниченную эффективность; подробнее об этом мы писали в цикле об орфанных заболеваниях: «Руку, ногу и сердце: редкий АТТR-амилоидоз» [45].
Патисиран от Alnylam в августе 2018 получил одобрение FDA ─ препарат этот показан для снижения симптомов связанной с hATTR полинейропатии; а болезнь эта вызывается повреждением периферических нервов. В клинических исследованиях терапия Патисираном приводила к общей стабилизации этого заболевания, а для некоторых пациентов также к улучшению симптомов: снижению проявлений болезни и повышению качества жизни. Эти эффекты были клинически значимыми и коррелировали с уменьшением концентрации белка TTR в плазме крови больных [46]. Конечно же, пока еще это далеко не панацея: имея ограниченную эффективность, Патисиран исцеления совсем не обещает, да и побочных эффектов вовсе не лишен [47]. Но поскольку стабилизирует симптомы опасной для жизни тяжелой болезни (для которой вообще-то существует не так много лечений) все еще остается вполне себе рабочим вариантом. Кстати один из его минусов, который неплохо бы преодолеть — вводить препарат нужно не менее раза в месяц, причем внутривенно, что снижает приверженность к терапии.
И вот тут-то на сцену выходит Вутрисиран (Amvuttra) — а это уже следующее поколение РНК-терапии от Alnylam . Его подкожное введение раз в три месяца (всего 4 инъекции в год!) оказалось не только удобнее, но и эффективней [48]: в исследовании HELIOS-A он снижал уровень TTR на 87,6%, значительно улучшая показатели пациентов по модифицированной шкале степени выраженности невропатических нарушений (mNIS+7) [49], а у 56,8% пациентов улучшались также и показатели качества жизни (согласно опроснику Norfolk QOL-DN) через 18 месяцев [50], [51]. Но и это еще не все.
Выше мы упомянули, что эффективность РНК-лекарств во многом определяется возможностью их доставки в сохранном виде, и что в первом одобренном препарате для этого уже применяли химическую модификацию, спасающую молекулу от разрушения внутриклеточными ферментативными системами. Подобные модификации использовали и в последующих лекарствах (причем в большем количестве, разнообразии и качестве [5], [52]); в том числе и в Патисиране, Гивосиране (о нем чуть ниже), ну и в Вутрисиране. Помимо таких «мелких» молекулярных правок в Патисиране и Гивосиране впервые применили и еще две довольно мощные технологии. В первом из них РНК упаковывали в липидные наночастицы, а во втором таргетные молекулы еще соединяли с особыми функциональными группами ─ N-ацетилгалактозаминами (GalNAc).
Укрытие РНК в липидную оболочку создает из нее своего рода «капсулу», которая может эффективно поглощаться клетками, что когда-то послужило базой для доставки в клетки антиковидных вакцин, позволив на основе этой платформы быстро разработать и вывести на рынок «рабочие» препараты от Moderna и Pfizer/BioNTech. Ну а GalNAc-частицы послужили платформой, улучшившей доставку многих последующих препаратов (вроде того же Вутрисирана), причем уже далеко не только от Alnylam (и даже не только для доставки РНК ─ см. например кейс препарата Verve-102 для генного редактирования [53]). Секрет этой технологии в том, что функциональные группы GalNAc хорошо связываются с одним из рецепторов на поверхности клетки печени, дополнительно увеличивая сродство препарата и, как следствие ─ его проникновение в клетку. Это-то и улучшает адресную доставку таких лекарств, выводя их эффективность на совершенно новый уровень.
Вутрисиран был одобрен в США и Европе в 2022 году по тем же показаниям, что и Патисиран; однако позитивные результаты последующего исследования HELIOS-B способны послужить основанием для расширенного одобрения: при вызванной транстиретиновым амилоидозом кардиомиопатии. Данные этого исследования показали, что риски смертности у принимавших Вутрисиран пациентов снижались аж на 36% (за 42 месяца) [54]. А это уже похоже на прорыв в лечении.
Еще один успех Alnylam — Гивосиран (Givlaari) для лечения редкого генетического заболевания — острой печеночной порфирии (ОПП). Эта болезнь возникает из-за дефекта биосинтеза структурной единицы гемоглобина — гема, что приводит к накоплению его токсичных предшественников — порфиринов (а это может быть весьма опасно). Приступы ОПП способны вызывать невыносимую боль, паралич конечностей, приводить к коме и даже к смерти, а стандартная терапия (гемином) хоть и купирует проявления таких жизнеугрожающих симптомов, но совсем не вылечивает и далеко не всегда предотвращает их рецидивы [52].
Гивосиран был одобрен FDA в 2019, он нацелен на ингибирование биосинтеза ALAS1 [55] ─ одного из ключевых ферментов синтеза гема. В исследовании ENVISION он сокращал частоту приступов на впечатляющие 74% [56]. Особенно учитывая, что вводится препарат раз в месяц подкожно: не самый плохой вариант для сохранения приверженности к лечению (обо всех нюансах этой терапии читайте: «РНК-интерференция: повторный успех» [52]).
Не менее выдающиеся результаты показывает Лумасиран (Oxlumo) против первичной гипероксалурии типа 1 (ПГ1) — наследственной болезни, при которой дефицит одного из важных ферментов прерывает цепочку биохимических превращений, приводя к накоплению разрушающего почки оксалата. У здорового человека такой проблемы конечно нет: организм избавляется от оксалата сам, фильтруя его из крови почками (а затем и выводя с мочой). А вот у людей с ПГ1 это вещество имеет свойство накапливаться, связываясь с кальцием, что способствует образованию почечных камней. Такой вот неприятный патогенез вызван мутацией гена AGXT, нарушающей работу (внимание!) аланин-глиоксилатаминотрансферазы. Этот печеночный фермент в норме обезвреживает биохимического предшественника оксалата — вещество глиоксилат (глиоксиловую кислоту), переводя его в совсем безобидный глицин (рис. 8). Без лечения ПГ1 ведет к почечной недостаточности. Некоторым пациентам из-за этого может потребоваться очень серьезное медицинское вмешательство: трансплантация печени и почек [57].
Лумасиран «выключает» ген, кодирующий гликолатоксидазу — фермент, участвующий в биосинтезе того самого глиоксилата, что снижает выработку оксалата на 65–72%, как показали исследования ILLUMINATE-A и ILLUMINATE-B [58]. Препарат этот, одобренный к применению еще в 2020 году, на сегодняшний день прошел уже пять клинических испытаний, показав превосходную эффективность с небольшим количеством побочных явлений [59]. Для страдающих ПГ1 детей, подверженных рискам развития почечнокаменной болезни и связанной с этим необходимостью в радикальном хирургическим вмешательстве — Лумасиран может стать «спасительным кругом», даря надежду на излечение.
Среди перспективных разработок Alnylam выделяется также Фитусиран (Qfitlia) для лечения гемофилий A и B (за коммерциализацию отвечает Sanofi). В отличие от текущего стандарта лечения этой болезни ─ заместительной терапии факторами свертывания , требующего достаточно частых внутривенных инъекций (зачастую еженедельных), этот препарат действует как бы по принципу обратной связи: хотя и не привносит необходимые элементы, но «заставляет» лучше работать в крови то, что уже есть. А конкретнее ─ Фитусиран воздействует на антитромбин — белок, который регулирует свертывание крови, подавляя его синтез с помощью РНК-интерференции. Это позволяет восстановить естественный процесс свертывания крови у пациентов, делая лечение более физиологичным.
Разработка рекомбинантных факторов свертывания в свое время произвела настоящую революцию, позволив гораздо эффективней и безопасней контролировать течение гемофилий. Прочитать об этом историческом прорыве можно в нашей флагманской статье: «Три поколения лекарств» [2].
В клинических исследованиях Фитусиран снижал годовую частоту кровотечений на 71–73%, причем вводить препарат надо подкожно и всего лишь раз в два месяца. Что важно, это лекарство может использоваться и теми, кто имеет антитела к факторам свертываемости: эффективность терапии для таких пациентов практически не отличалась от группы больных без антител-ингибиторов. Все эти факторы не смогли не учесть регуляторы, благодаря чему в марте 2025 года Фитусиран и получил от FDA одобрение [60].
Надо сказать, что Alnylam может радикально изменить подходы к лечению даже «банального» повышенного давления ─ гипертонии (или артериальной гипертензии) опять же ─ РНК-интерференцией. Несмотря на обилие существующих в этой области препаратов ─ от β-блокаторов до ингибиторов АПФ , ─ проблема контроля давления остается весьма острой: не для всех пациентов стандартная терапия оказывается достаточно эффективной (а ведь в мире таких больных более миллиарда [61]). Экспериментальный препарат от Alnylam Зилебесиран действует принципиально иначе, чем «обычные» таблетки от давления: вместо блокировки рецепторов или ферментов он «выключает» в печени ген ангиотензиногена (АГТ) ─ биохимического предшественника ангиотензина. Последний отвечает за повышение кровяного давления, так что нарушение его синтеза ─ напротив, должно вполне закономерно это давление снижать.
О том, как появились все эти важные препараты и как они действуют — снова здесь: «Три поколения лекарств» [2].
Клинические данные пока показывают, что так и происходит: однократная инъекция этого лекарства демонстрировала заметное снижение артериального давления (АД) у лиц с легкой и умеренной гипертензией — эффект длился до полугода. Те, кто получал Зилебесиран, с большей вероятностью достигали среднего систолического АД менее 130 мм рт. ст. за 24 часа по сравнению с контрольной группой [62]. Сейчас препарат тестируется в фазе II. Если эффективность подтвердится, гипертоники смогут заменить «горсти таблеток» на две инъекции в год — это не просто удобнее, но и может резко повысить приверженность лечению. Для Alnylam, уже меняющей подходы к терапии редких болезней, это шанс совершить прорыв в лечении одной из самых распространенных патологий.
Другие препараты РНК-интерференции
Если Alnylam — пионер в терапевтической РНК-интерференции, то другие компании быстро подхватили эту технологию, направив ресурсы на исследования своих оригинальных препаратов (и результаты не заставили себя долго ждать). Например, в начале 2025 года FDA приняло заявку на одобрение нового препарата под названием Плозасиран (от Arrowhead Pharmaceuticals), предназначенного для лечения семейной хиломикронемии — редкого генетического нарушения липидного обмена, характеризующегося повышенным уровнем триглицеридов в крови и связанным с этим высоким риском развития панкреатита и сердечнососудистых заболеваний. Данная болезнь может вызываться различными мутациями, но результатом их всегда является нарушение клиренса «переносчиков жиров» ─ хиломикронов. Это приводит к их накоплению в плазме крови, и, как следствие ─ к разбалансировке липидного обмена.
Плозасиран, ранее известный как ARO-APOC3, направлен на снижение выработки аполипопротеина C-III (APOC3), компонента богатых триглицеридами липопротеинов и ключевого регулятора их метаболизма. Этот белок, хоть напрямую и не способен увеличивать количества триглицеридов, влияет на их выведение, а потому опосредованно их повышает (особенно если в организме его много). Соответственно, его ингибирование, ─ наоборот, снизит триглицериды в крови, что и осуществляет Плозасиран. Клинические исследования показали выраженное снижение триглицеридов (на 80%) и существенное уменьшение риска развития острого панкреатита (на 83%) у пациентов, принимавших Плозасиран. При этом препарат в целом хорошо переносился. Очевидно, эти обнадеживающие данные ─ хорошая основа для дальнейшей разработки и коммерциализации препарата, что, по-видимому, осознали и в FDA: регулятор присвоил Плозасирану статус прорывной терапии (Breakthrough Therapy Designation), обеспечивающий ускоренное рассмотрение ведомством [63].
Еще один интересный препарат ─ Недосиран (Rivfloza), разработка компании Dicerna Pharmaceuticals, ныне часть Novo Nordisk. Это лекарство, как и упомянутый выше Лумасиран, используется для лечения ПГ1, но в отличие от него нацелено на ингибирование лактатдегидрогеназы (LDH) — одного из ключевых ферментов, участвующих в образовании оксалатов (рис. 8).
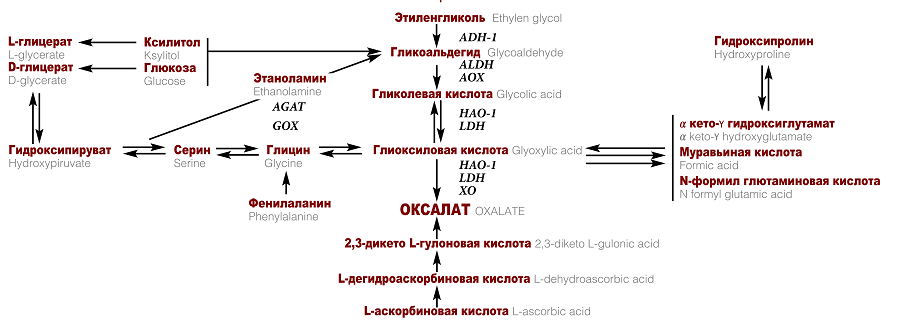
Рисунок 8. Пути синтеза эндогенного оксалата в организме.
Недосиран получил одобрение от FDA в сентябре 2023 года, ознаменовав дополнительный прогресс в лечении ПГ1: теперь в этой области появилась новая стратегия ведения пациентов в возрасте от 9 лет и старше с относительно сохранной функцией почек. Одобрение было основано на данных клинических испытаний, продемонстрировавших эффективность и неплохой профиль безопасности препарата. В фазе 1 испытаний PHYOX1 среднее максимальное снижение уровня оксалатов в моче у пациентов составило 66%. Последующее исследование фазы 2 (PHYOX2) также достигло своей первичной конечной точки, продемонстрировав статистически значимое снижение выведения оксалатов с мочой в сравнении с плацебо. Все эти данные прокладывают дорогу для дальнейших исследований долгосрочной эффективности и безопасности этого и других подобных препаратов [65].
А вот например Silence Therapeutics, хотя и отстает пока в «гонке за одобрениями» [66], но их Зерласиран, нацеленный на ингибирование липопротеина (а) [Lp(a)] — одного из ключевых факторов риска развития атеросклероза, — демонстрирует многообещающие результаты. Lp(a) повышен у 20% населения и обусловлен генетически, из-за чего с его негативным воздействием не вполне справляются традиционные методы профилактической терапии: прием статинов или ведение «правильного» образа жизни (включающего специальные диеты и регулярное выполнение физических упражнений) далеко не всегда помогают эффективно снижать концентрации Lp(a). При этом высокий его уровень напрямую коррелирует с повышенным риском развития атеросклеротических сердечнососудистых осложнений, что делает этот липопротеин одной из важнейших и нерешенных (пока еще) проблем кардиологии.
Зерласиран избирательно подавляет синтез Lp(a), приводя к значительному снижению его уровня — до 80% и более, что подтверждается в клинических испытаниях. Способ введения и достаточно редкий режим дозирования (всего несколько подкожных инъекций в год) способствуют приверженности пациентов к лечению. Данные клинических испытаний фазы II продемонстрировали, что при таком вот нечастом приеме препарат обладает потенциалом для обеспечения даже долгосрочного снижения уровней Lp(a) [67].
Сейчас уже все с нетерпением ждут перехода этого многообещающего метода лечения в фазу III с перспективой дальнейшего одобрения; ведь учитывая распространенность повышенного Lp(a) и его вклада в смертность, Зерласиран также может стать одним из важнейших инструментов в борьбе с сердечнососудистыми заболеваниями уже в ближайшие годы .
К сожалению, с запуском фазы III пока еще решили повременить сами Silence, ища коммерческого партнера для снижения финансовых издержек [66].
Другой препарат, успешно борющийся с сердечнососудистыми заболеваниями — Инклисиран от Novartis. Это лекарство воздействует на весьма популярную в последнее время мишень — фермент PCSK9, ингибируя кодирующий его ген (рис. 9).
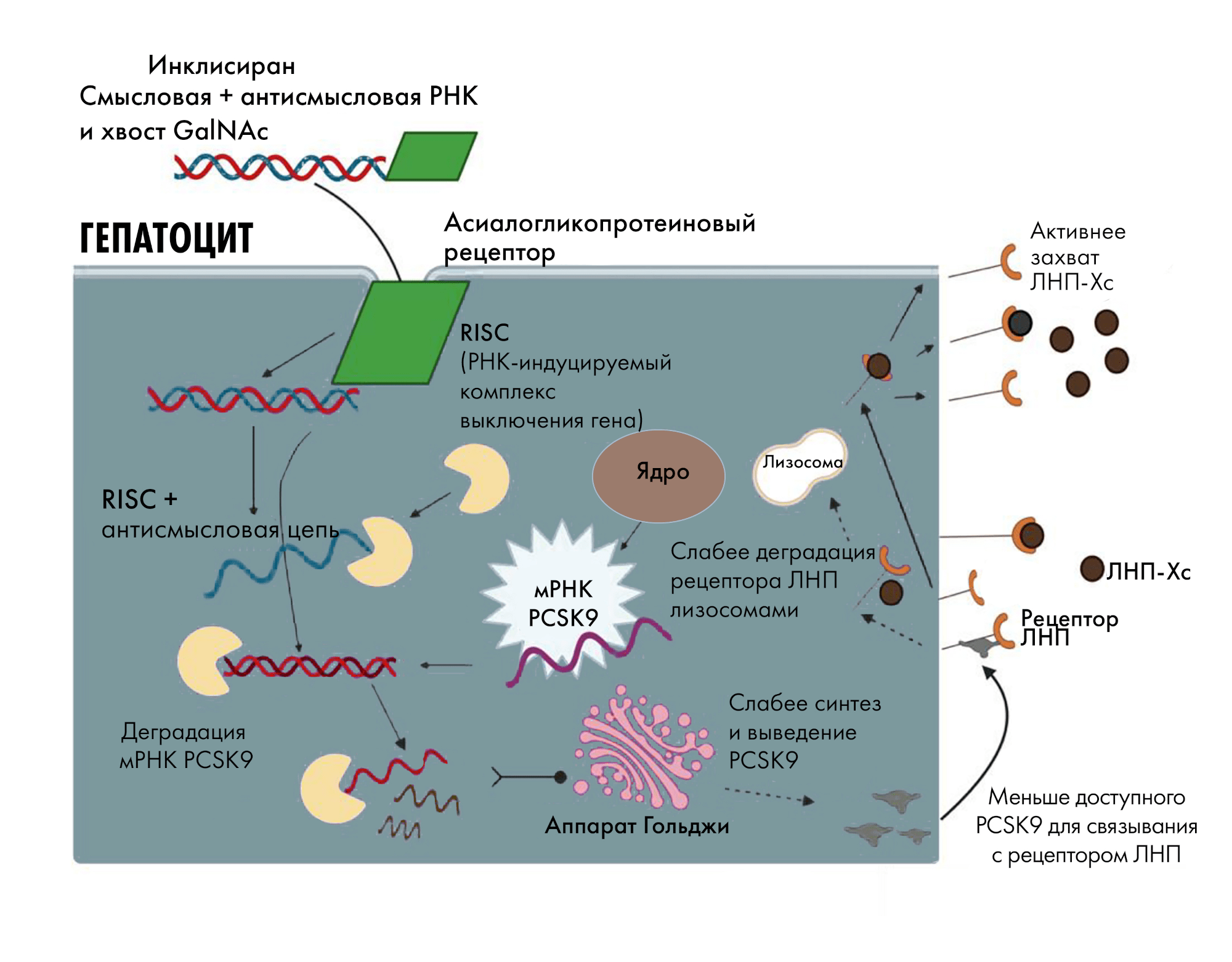
Рисунок 9. Механизм действия Инклисирана. Попадая в клетки печени, он связывается с кодирующей PCSK9 мРНК, предотвращая ее перевод в белковую последовательность, а значит, блокируя выработку соответствующего фермента-мишени. Поскольку белка PCSK9 становится меньше, количество ингибируемых им рецепторов ЛПНП (липопротеинов низкой плотности), напротив, увеличивается; ну а так как эти рецепторы отвечают за абсорбцию (поглощение) и деградацию ЛПНП — их повышение по принципу обратной связи снижает уровни ЛПНП. Расшифровка сокращений: GalNAc — N-acetylgalactosamine; ЛНП — липопротеин низкой плотности; ЛНП-Хс — ЛНП-холестерин; PCSK9 — proprotein convertase subtilisin/kexin type 9; RISC, RNA-induced silencing complex; siRNA — small interfering RNA.
Вообще, появление Инклисирана (первоначально разработанного все той же компанией Alnylam) — важный прецедент в истории современной медицины: его успех обусловлен результатами масштабных клинических испытаний, продемонстрировавших способность эффективно снижать уровни ЛПНП, предотвращая развитие сердечнососудистых болезней. Препарат, первоначально одобренный в ЕС в 2020 году, вскоре был одобрен к применению и в Великобритании, затем в США (2021 год), после в России (в 2022 году под коммерческим наименованием Сибрава), а в Китае — в 2023 году. Эти решения были основаны на строгих научных доказательствах, полученных в исследованиях, входящих в многоцентровую международную программу ORION, которая продолжается и по сей день. Цель этой серии клинических исследований — выяснить, насколько может помочь Инклисиран больным с тяжелыми дислипидемиями , лечение которых более традиционными препаратами (такими как статины или Эзетимиб) оказалось недостаточно эффективным [69].
Состояния, характеризующиеся [70] максимальным накоплением «плохого» холестерина (ЛПНП) [71] и триглицеридов.
В частности, исследование ORION-3 показало, что Инклисиран способен значительно снижать концентрации ЛПНП даже у пациентов с тяжелыми проявлениями сердечнососудистых болезней или высокими факторами риска (например, наследственной предрасположенностью или метаболическими нарушениями, такими как диабет). После всего двух подкожных инъекций Инклисирана (по 300 мг каждая) в первый год было достигнуто устойчивое снижение ЛПНП примерно на 47,5%. Впоследствии средняя эффективность лечения также оставалась на высоком уровне, поддерживая общее снижение «плохого холестерина» на ≈45% в течение 2–4 лет наблюдений [72]. Важно отметить, что такие серьезные изменения были достаточно безопасны: наблюдались лишь легкие нежелательные явления, не больше, чем в контрольной группе (в основном небольшие реакции в месте инъекций).
В дальнейшем Инклисиран исследовали еще многократно: клинических испытаний сейчас уже зарегистрировано более 90, а их данные в целом подтверждают более ранние результаты: наблюдается устойчивое снижение уровней ЛПНП с благоприятным профилем безопасности, что и делает этот препарат весьма ценным дополнением для пациентов с повышенным риском сердечнососудистых осложнений [73].
Антисенсы
К сожалению, резюмируя данные об эффективности антисенсов, приходится констатировать довольно-таки печальную картину. Появление этих препаратов когда-то вселяло надежду, что эта новая терапевтическая модальность станет серьезным прорывом в лечении многих болезней, но спустя четверть века после одобрения первого антисенса по-настоящему крупных успехов в этой области немного. С некоторыми оговорками к таковым можно отнести вышеупомянутую «Спинразу»: правда, несмотря на реальную эффективность, это далеко не панацея (к тому же, «Золгенсма» и «Эврисди» составляют ей серьезную конкуренцию на рынке).
Как это ни парадоксально, но с момента выхода в 2017 году нашего первого обзора об антисенсах (рекомендуем к ознакомлению: «Есть ли смысл в антисенсах?» [5]), в общем-то, не так много в этой области изменилось (по крайней мере, в лучшую сторону). К определенным успехам за это время можно отнести буквально пару-тройку лекарств (но и то с большими оговорками).
Отметим Тоферсен от Biogen [15], одобренный для применения в 2023 году в США (а затем и в ЕС в 2024-м) для лечения бокового амиотрофического склероза (БАС). Как показали исследования, при применении этого лекарства снижались целевые биохимические маркеры в спинномозговой жидкости и плазме крови (белок SOD1 и легкие цепи нейрофиламентов — NfL [74]), что говорит о замедлении развития БАС и улучшении состояния пациентов, оцениваемого по специализированной шкале ALSFRS-R [75]. Все эти данные имели некоторую клиническую значимость , и потому Тоферсен, вероятно, нельзя считать однозначным провалом (учитывая «беспощадность» БАС и трудность его лечения). В то же время препарат этот от данной болезни отнюдь не избавляет, представляя лишь одну из более-менее приемлемых (на текущий момент) опций ее терапии.
Здесь говорим об интегративных данных из свежего системного метаанализа [76]; клинические же испытания на момент одобрения лекарства показывали более скромные результаты [77].
Другой относительно позитивный пример — Инотерсен от Ionis Pharmaceuticals. Хотя этот препарат заметно уступает по эффективности и безопасности Патисирану (применяемому по тому же показанию — полинейропатии при наследственном транстиретиновом амилоидозе), он все же может принести пользу тем пациентам, которым другие лекарства не подходят из-за плохой переносимости [78]. (Если только в этом случае выбор падет именно на Инотерсен — в настоящее время существует несколько альтернативных опций в лечении hATTR.) А вот, Эплонтерсен (совместное детище Ionis и AstraZeneca) показывал в исследованиях эффективность и безопасность, сопоставимую с данными по Вутрисирану, благодаря чему и был одобрен FDA по hATTR в 2023 году (пожалуй, это одно из самых перспективных «антисмысловых» лекарств, вышедших за последние годы [79]).
Конечно, говоря об антисенсах, никак нельзя обойти крайне спорные одобрения препаратов для лечения миодистрофии Дюшенна (МДД) [80], работающих по принципу exon-skipping. Суть тут в том, что некоторые мутации у пациентов с МДД вызывают сдвиг рамки считывания при экспрессии дистрофина; это можно предотвратить, исключив поврежденный генным дефектом экзон. Именно по такому принципу действуют exon-skipping антисенсы: связываясь комплементарно с последовательностью экзона, они маскируют его таким образом, чтобы он был пропущен при сплайсинге; результатом этого становится укороченный, но все еще функциональный белок. В теории это должно уменьшать симптомы, улучшая течение болезни, но как говорится гладко было на бумаге…
Дело в том, что имеющиеся на сегодня одобрения работающих по данному принципу лекарств (Этеплирсена, Голодирсена, Вилтоларсена и Касимерсена) основываются на довольно сомнительных результатах клинических испытаний, и «случились» они во многом из-за давления общественности; а также из-за чересчур снисходительной регуляторной политики FDA в отношении препаратов с острой неудовлетворенной потребностью. По данным исследований эти препараты зачастую улучшали продукцию дистрофина лишь на десятые доли процента, в то время как по мнению врачей, такое повышение должно составлять не менее 10% [81]. Скромными были и улучшения функциональности и физиологического (например, повышения мышечной массы) состояния пациентов.
Обобщая, можно сказать, что от этих препаратов настоящая клиническая польза пока скорее подразумевается, чем реально присутствует (а ведь все они уже есть в продаже и обходятся в сотни тысяч долларов в год).
Лекарства на основе других типов РНК
Хотя фармкомпании в настоящее время сосредоточены на разработке препаратов на основе «проверенных» РНК-платформ (что вполне логично), предпринимаются также попытки «приручить» и другие, менее известные типы этих молекул. Например, транспортные РНК (тРНК), микроРНК (миРНК) или даже весьма экзотические кольцевые РНК (circRNA).
Все эти «темные лошадки» [20] обладают уникальным потенциалом, и хотя пока еще рановато всерьез обсуждать их перспективы, любопытно было бы заглянуть за горизонты возможного будущего; повнимательнее приглядеться к таким пока еще очень «незрелым», но уже весьма многообещающим технологиям. Например, Alltrna разрабатывает терапию на основе транспортной РНК, используя уникальную технологию: их подход нацелен на коррекцию «сборки белка» (трансляцию). Данная компания создает синтетические тРНК, способные исправлять вызванные нонсенс-мутациями ошибки в трансляции — а это такие генетические дефекты, которые приводят к образованию стоп-кодонов.
Другая довольно интересная модальность разрабатывается на базе миРНК, которая, как мы уже знаем (наряду с siRNA), способна деградировать транскрипты, останавливая выработку кодируемых ими белков. Кандидат AMT-130 от uniQure как раз и использует такую технологию: миРНК доставляется в клетки аденоассоциированным вектором [83], нацеливаясь на разрушение РНК-последовательностей гена HTT. Ген этот кодирует белок гентингтин, мутации в котором играют ключевую роль в развитии болезни Хантингтона.
В замедлении прогрессирования этого недуга и помогает AMT-130; причем препарат с этим, похоже, справляется [84]: по крайней мере, судя по двум клиническим испытаниям фаз 1/2, проведенным у взрослых пациентов с ранними стадиями заболевания .
Так что, видимо, это сейчас самая перспективная из рассматриваемых в этом разделе РНК-платформ. Успеху здесь может также поспособствовать уникальный опыт uniQure в разработке препаратов генной терапии: в частности мы уже писали об их достижениях в лечении гемофилий [85], [86].
Ну и последняя модальность, на которую хотелось бы обратить ваше внимание, ─ circRNA: данную платформу уже тестируют Orna Therapeutics [87]. Они разрабатывают подход, при котором можно было бы осуществлять внутриорганизменную (in vivo) доставку кольцевой РНК в иммунные клетки; при этом рибонуклеиновая кислота тут должна кодировать последовательности CAR-рецепторов.
Про CAR-T, мы, кстати, также уже не раз писали. Суть данной технологии: из организма извлекают иммунные Т-клетки (лимфоциты), генно-модифицируют в лаборатории, размножают и вводят пациенту обратно. После модификации эти лимфоциты содержат на поверхности CAR-рецептор, способный узнавать и уничтожать опухолевые клетки.
И вот какую альтернативу такому подходу предлагают в Orna: так рационально конструировать кольцевые РНК, чтобы они доставляли кодирующие CAR-рецептор последовательности внутрь организма (то есть модифицировать лимфоциты in vivo). Это позволит избежать извлечения лимфоцитов из организма и генной модификации и размножения клеток в лаборатории (ведь это долго и дорого).
Потенциал такого подхода огромен. Его глобальное внедрение вполне способно снизить нагрузку на системы здравоохранения, превратив длительное, дорогое и технически сложное персонализированное лечение в гораздо более простую процедуру. Здесь пациенту нужно будет лишь потерпеть совсем простой укол молекулы circRNA. (Впрочем, пока еще эта терапия остается больше на уровне концепта.)
Обозревая горизонты: цифры, тенденции и будущие ожидания от РНК-терапий
Обсудим общую картину: интересно посмотреть, как сейчас выглядит «ландшафт» РНК-лечения в целом, если немного абстрагироваться от отдельных кейсов, имеющихся (и описанных выше) успехов и неудач. Сейчас только в США одобрена 21 терапия на основе РНК, включая десять ASO, шесть siRNA и пять вакцин на основе мРНК. При этом ASO и siRNA представлены на рынке в различных терапевтических областях (в лечении метаболических, сердечнососудистых и неврологических заболеваний), в то время как одобренные продукты на основе мРНК ─ это пока что исключительно вакцины для профилактики инфекционных заболеваний.
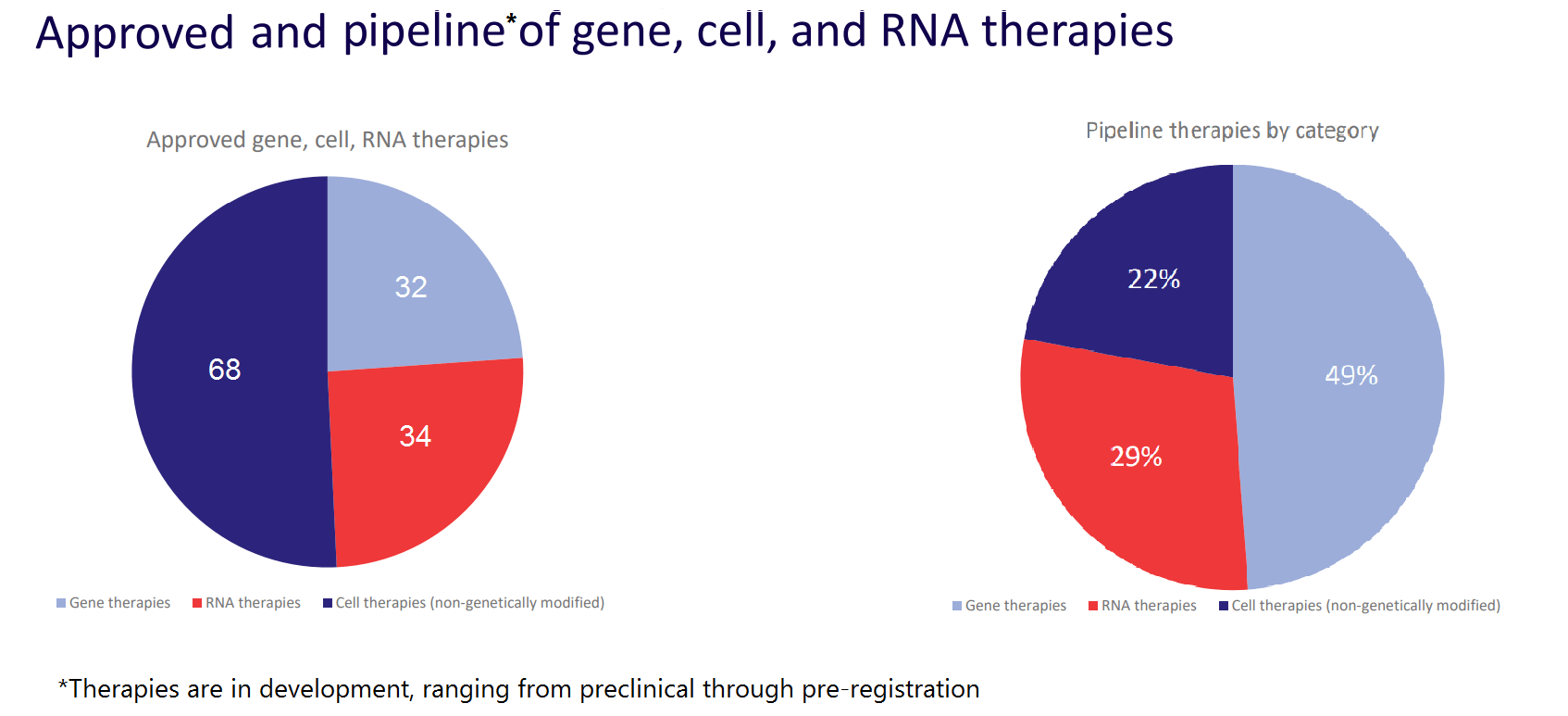
Рисунок 10. Спектр одобренных для применения и разрабатываемых лечений. Во всем мире одобрены: 32 метода генной терапии; 34 метода РНК-терапии; 68 методов клеточных терапий. Процентные соотношения находящихся в разработке терапий: 49% генные терапии; 29% РНК-терапии; 22% клеточные терапии.
Кроме того, сейчас больше сотни препаратов находятся на различных стадиях клинических испытаний. Стоит отметить также, что в последнее время количество одобренных препаратов на основе РНК-терапии начало немного превышать число регистраций других видов генной терапии, что явно указывает на большой интерес инвесторов и больших игроков фармрынка к этой технологии (рис. 10).
Что еще интересно, крупнейшей исследовательской областью являются кардиометаболические расстройства: на них приходится почти треть всех существующих в РНК-лечении разработок; второе место занимает онкология, а третье — заболевания центральной нервной системы (рис. 11).
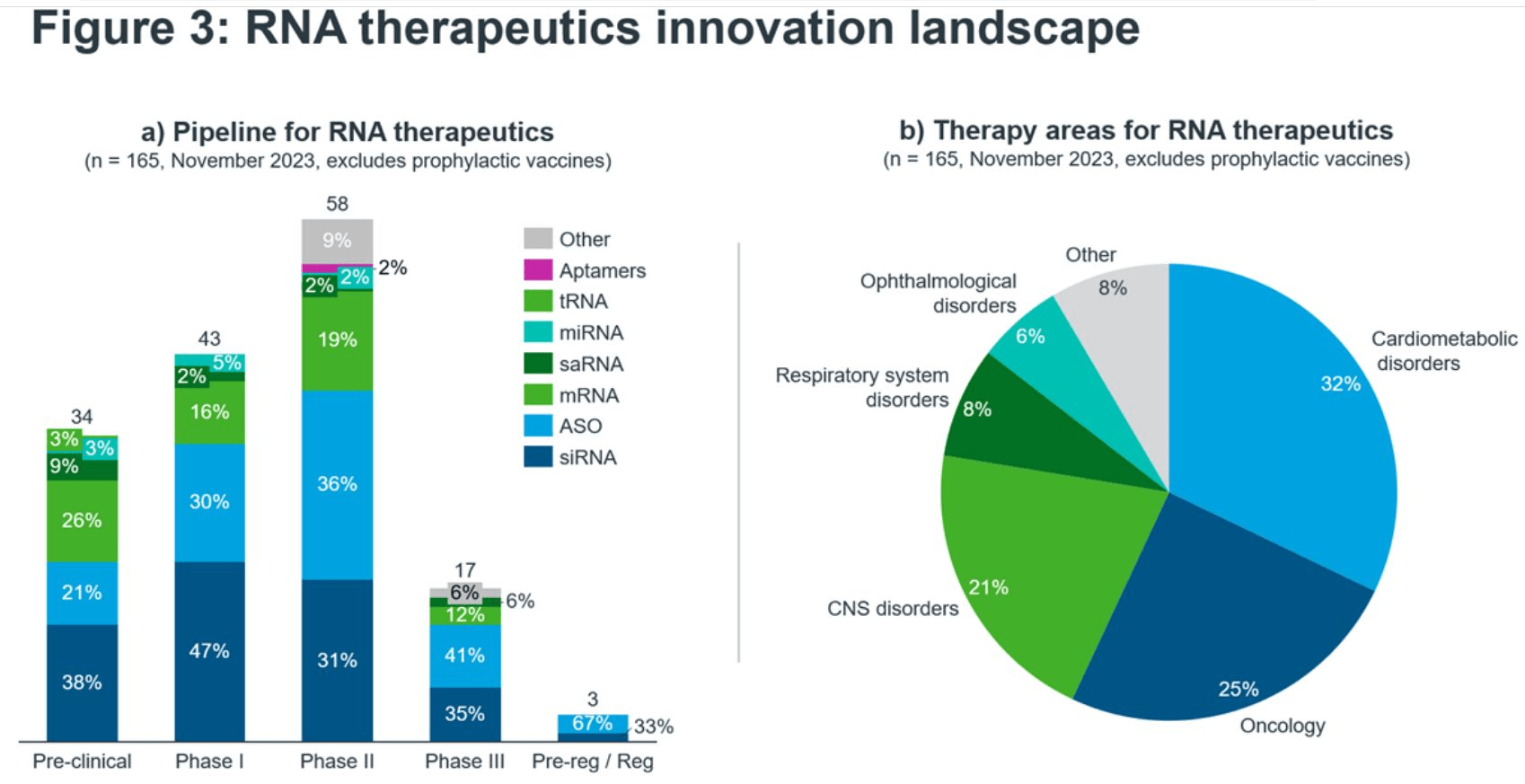
Рисунок 11. Ландшафт инноваций в области РНК-терапий.
При этом из наиболее востребованных РНК-платформ выделяются siRNA, ASO и мРНК, в совокупности составляющие 80% от всего «ассортимента» продуктов, что, в общем-то, и неудивительно (рис. 11). Как мы уже могли видеть, все эти три модальности на сегодняшний день наиболее «зрелые»: здесь уже есть одобренные продукты с продемонстрированным коммерческим успехом.
Особенно же важно, что РНК-терапии постепенно охватывают и распространенные болезни, что еще раз подтверждает пользу от таких технологий (вспоминаем вышеупомянутые Инклисиран и Зилебесиран). Очевидно, понимание лежащих в основе патогенеза фундаментальных биологических процессов растет, а медицинские решения в области РНК-терапии совершенствуются, что становится все заметнее не только для орфанных, но и для чаще встречающихся мультифакторных болезней.
Конечно же, «глобальный» выход РНК терапий (как и других генных лечений) в более широкое применение пока только ожидается, но в целом уже сейчас очевидно, какие это несет плюсы для медицины и человечества в целом. Ведь РНК-медикаменты, наряду с другими продвинутыми терапиями, буквально на наших глазах (медленно, но верно) переворачивают игру, переписывая правила лечения ранее безнадежных болезней.
Литература
- Phei Er Saw, Erwei Song. (2024). Advancements in clinical RNA therapeutics: Present developments and prospective outlooks. Cell Reports Medicine. 5, 101555;
- Три поколения лекарств;
- мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Есть ли смысл в антисенсах?;
- Ralf Dahm. (2008). Discovering DNA: Friedrich Miescher and the early years of nucleic acid research. Hum Genet. 122, 565-581;
- Выделяем нуклеиновые кислоты: эволюция методов;
- Xiaoyi Sun, Sarra Setrerrahmane, Chencheng Li, Jialiang Hu, Hanmei Xu. (2024). Nucleic acid drugs: recent progress and future perspectives. Sig Transduct Target Ther. 9;
- Young-Kook Kim. (2022). RNA therapy: rich history, various applications and unlimited future prospects. Exp Mol Med. 54, 455-465;
- 12 методов в картинках: структурная биология;
- Alexander Rich, David R. Davies. (1956). A NEW TWO STRANDED HELICAL STRUCTURE: POLYADENYLIC ACID AND POLYURIDYLIC ACID. J. Am. Chem. Soc.. 78, 3548-3549;
- Zhang S., Egli M. (2024). Biographical Memoirs: Alexander Rich. National Academy of Sciences;
- Rich A. (2006). Alex Rich on Julian Huxley Comments on the Discovery of Nucleic Acid Hybridization. CSHL Digital Archives;
- Alexander Rich. (1960). A HYBRID HELIX CONTAINING BOTH DEOXYRIBOSE AND RIBOSE POLYNUCLEOTIDES AND ITS RELATION TO THE TRANSFER OF INFORMATION BETWEEN THE NUCLEIC ACIDS. Proc. Natl. Acad. Sci. U.S.A.. 46, 1044-1053;
- Генная терапия нейромоторных болезней;
- Модельные организмы: нематода;
- Felekkis K. and Deltas C. (2006). RNA Intereference: a powerful laboratory tool and its therapeutic implications. Hippokratia. 10, 112–115;
- Anton P. McCaffrey, Leonard Meuse, Thu-Thao T. Pham, Douglas S. Conklin, Gregory J. Hannon, Mark A. Kay. (2002). RNA interference in adult mice. Nature. 418, 38-39;
- МикроРНК с огромным влиянием — за что вручили Нобелевскую премию по медицине (2024);
- Обо всех РНК на свете, больших и малых;
- Связанные одной лентой;
- Anke Sparmann, Jörg Vogel. (2023).
RNA ‐based medicine: from molecular mechanisms to therapy. The EMBO Journal. 42; - Самое дорогостоящее лекарство в мире;
- СМА: три буквы — три лекарства;
- Надежда для СМАйликов;
- Гонка во спасение: безопасны ли вакцины против коронавируса?;
- Вакцины против коронавируса: перспективы;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Пембролизумаб снижает риск развития отдаленных метастазов или смерти на 40 % по сравнению с плацебо при применении в качестве адъювантной терапии меланомы III стадии. (2020). MSD;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Justin F Gainor, Manish R Patel, Jeffrey Weber, Martin Gutierrez, Julie E Bauman, et. al.. (2023). 1530 T-cell responses to individualized neoantigen therapy (INT) mRNA-4157 (V940) as monotherapy or in combination with pembrolizumab. Late-Breaking Abstracts. A1754-A1754;
- Отношение рисков. (2025). JoVE;
- Immunology 101 - Lesson 3. (2020). Understanding Cancer Immunotherapy Research;
- Дмитриева Е. (2018). Протоковая аденокарцинома поджелудочной железы. Medach;
- Apoorva Mehta, Mateen Motavaf, Ikenna Nebo, Sophia Luyten, Kofi D. Osei-Opare, Alejandro A. Gru. (2025). Advancements in Melanoma Treatment: A Review of PD-1 Inhibitors, T-VEC, mRNA Vaccines, and Tumor-Infiltrating Lymphocyte Therapy in an Evolving Landscape of Immunotherapy. JCM. 14, 1200;
- Респираторно-синцитиальный вирус (РСВ). (2025). «Всемирная организация здравоохранения»;
- Patricio L. Acosta, Mauricio T. Caballero, Fernando P. Polack. (2016). Brief History and Characterization of Enhanced Respiratory Syncytial Virus Disease. Clin Vaccine Immunol. 23, 189-195;
- Linnane C. (2024). Moderna’s stock falls after data shows biotech’s RSV vaccine trails rivals after 18 months. MarketWatch;
- Karen Kelleher, Nadisha Subramaniam, Simon B. Drysdale. (2025). The recent landscape of RSV vaccine research. Therapeutic Advances in Vaccines and Immunotherapy. 13;
- Муковисцидоз — первые надежды;
- FDA присвоило орфанный статус препарату для лечения муковисцидоза от Arcturus. (2023). GxP News;
- Arcturus Therapeutics Announces Initiation of Dosing in Phase 2 Multiple Ascending Dose Studies for Cystic Fibrosis (CF) and Ornithine Transcarbamylase (OTC) Deficiency. (2025). Arcturus Therapeutics;
- Ana Rita Batista, Terence R. Flotte. (2021). In vivo gene editing works in humans: Results of a phase 1 clinical trial for TTR amyloidosis. Molecular Therapy. 29, 2633-2634;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- Luca Gentile, Massimo Russo, Marco Luigetti, Giulia Bisogni, Andrea Di Paolantonio, et. al.. (2021). Patisiran in hATTR Amyloidosis: Six-Month Latency Period before Efficacy. Brain Sciences. 11, 515;
- Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!;
- Patisiran for hereditary transthyretin amyloidosis: lesser benefit than vutrisiran. (2024). IQWiG;
- P. James B. Dyck, A. González-Duarte, L. Obici, M. Polydefkis, J.F. Wiesman, et. al.. (2019). Development of measures of polyneuropathy impairment in hATTR amyloidosis: From NIS to mNIS + 7. Journal of the Neurological Sciences. 405, 116424;
- Norfolk. (2023). Alnylam;
- David Adams, Ivailo L. Tournev, Mark S. Taylor, Teresa Coelho, Violaine Planté-Bordeneuve, et. al.. (2023). Efficacy and safety of vutrisiran for patients with hereditary transthyretin-mediated amyloidosis with polyneuropathy: a randomized clinical trial. Amyloid. 30, 18-26;
- РНК-интерференция: повторный успех;
- Переписывая код жизни: как инструменты генного редактирования могут навсегда изменить медицину?;
- Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер;
- Дмитриев Р. (2025). Гивосиран: успешная РНК-интерференционная терапия острой печеночной порфирии. «Мосмедпрепараты»;
- Bruce Wang, Paolo Ventura, Kei-ichiro Takase, Manish Thapar, David Cassiman, et. al.. (2022). Disease burden in patients with acute hepatic porphyria: experience from the phase 3 ENVISION study. Orphanet J Rare Dis. 17;
- Al Idrus A. (2019). Alnylam preps next filing as rare kidney disease med aces phase 3. Fierce Biotech;
- Фон Ройсс Т. (2025). «Окслумо»: первое лекарство против первичной гипероксалурии 1-го типа. «Мосмедпрепараты»;
- Xuan Gang, Fei Liu, Jianhua Mao. (2023). Lumasiran for primary hyperoxaluria type 1: What we have learned?. Front. Pediatr.. 10;
- FDA Approves Novel Treatment for Hemophilia A or B, with or without Factor Inhibitors. (2025). U.S. Food and Drug Administration;
- Гипертония. (2023). «Всемирная организация здравоохранения»;
- Atefeh Saljoughian Esfahani, Yasaman Vahdani, Payam Peymani, Soha Razmjouei, Mahdieh Ahmadnia, et. al.. (2024). Zilebesiran for treating hypertension; the result of recent findings. J Nephropathol. 13, e22542;
- Arrowhead Pharmaceuticals Announces Acceptance of New Drug Application by U.S. FDA of Plozasiran for the Treatment of Familial Chylomicronemia Syndrome. (2025). Arrowhead Pharmaceuticals;
- Prosyannikov M.Yu., Konstantinova O.V., Anohin N.V., Voytko D.A. (2019). The possibilities of herbal medicine using in calcium-oxalate urolithiasis metaphylaxis. Literature review. Experimental and clinical urology. 3, 104–118;
- How to find the chemical modification of nedosiran? (2024). PatSnap;
- Waldron J. (2025). Silence slows phase 3 plans for cardio drug, as Hansoh opts out of $1.3B biobucks collab. Fierce Biotech;
- James D. (2024). Zerlasiran Achieves Significant Sustained Reduction in Lipoprotein(a) Levels with Infrequent Dosing. Applied Clinical Trials;
- Oluwakemi Ebenezer, Pietro Comoglio, Gane Ka-Shu Wong, Jack A. Tuszynski. (2023). Development of Novel siRNA Therapeutics: A Review with a Focus on Inclisiran for the Treatment of Hypercholesterolemia. IJMS. 24, 4019;
- A.B. Sumarokov. (2022). Inclisiran — lipid-lowering drug using RNA therapy. Hypolipidemic potential. Kardio. vestn.. 17, 32;
- Дислипидемия. (2025). Клиника АО «Медицина»;
- Хороший, плохой, злой холестерин;
- Стрельцова Ю. (2025). Инклисиран: эффективное снижение холестерина при атеросклерозе. «Мосмедпрепараты»;
- Maan H. Harbi. (2025). Current usage of inclisiran for cardiovascular diseases: overview of current clinical trials. Front. Pharmacol.. 16;
- Lorenzo Gaetani, Kaj Blennow, Paolo Calabresi, Massimiliano Di Filippo, Lucilla Parnetti, Henrik Zetterberg. (2019). Neurofilament light chain as a biomarker in neurological disorders. J Neurol Neurosurg Psychiatry. 90, 870-881;
- Cedarbaum J.M. (2024). Revised Amyotrophic Lateral Sclerosis Functional Rating Scale (ALSFRS-R). MDCalc;
- Abdullah Ashraf Hamad, Ibraheem M. Alkhawaldeh, Abdulqadir J. Nashwan, Mostafa Meshref, Yahia Imam. (2025). Tofersen for SOD1 amyotrophic lateral sclerosis: a systematic review and meta-analysis. Neurol Sci. 46, 1977-1985;
- Стрельцова Ю. (2025). «Калсоди»: новое лекарство от бокового амиотрофического склероза с мутацией SOD1. «Мосмедпрепараты»;
- Дмитриев Р. Инотерсен мертв, да здравствует патисиран! «Мосмедпрепараты»;
- Campos J. (2024). Experts Highlight Eplontersen as a Breakthrough ATTR-PN Treatment. Rare Disease Advisor;
- Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна;
- Стеценко Д.А., Фокина А.А. (2025). Олигонуклеотиды для лечения мышечной дистрофии Дюшенна. «МойМио»;
- Philpott J. (2025). Alltrna plans to tackle rare diseases using tRNA-based therapies. Pharmaceutical Technology;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Maia M. (2025). FDA names AMT-130 a Huntington’s breakthrough therapy. Huntington’s Disease News;
- АМТ-061 — генная терапия, способная на революцию в лечении гемофилии;
- Как болезни крови генной терапией лечили;
- How Circular RNA is Enabling In Vivo CAR Delivery and Reducing Patient Treatment Burden. (2024). The Conference Forum.